พันธะขั้วโลกโควาเลนต์: สูตร คุณสมบัติ คุณสมบัติ พันธะโควาเลนต์
หัวข้อของตัวประมวลผลการตรวจสอบ Unified State: พันธะเคมีโควาเลนต์ พันธุ์และกลไกการก่อตัว ลักษณะเฉพาะ พันธะโควาเลนต์(ขั้วและพลังงานยึดเหนี่ยว) พันธะไอออนิก การเชื่อมต่อโลหะ พันธะไฮโดรเจน
พันธะเคมีภายในโมเลกุล
ก่อนอื่น เรามาดูพันธะที่เกิดขึ้นระหว่างอนุภาคภายในโมเลกุลกันก่อน การเชื่อมต่อดังกล่าวเรียกว่า ภายในโมเลกุล.
พันธะเคมี ระหว่างอะตอม องค์ประกอบทางเคมีมีลักษณะเป็นไฟฟ้าสถิตและเกิดขึ้นเนื่องจาก ปฏิสัมพันธ์ของอิเล็กตรอนภายนอก (วาเลนซ์)ในระดับมากหรือน้อย ถูกยึดโดยนิวเคลียสที่มีประจุบวกอะตอมที่ถูกพันธะ
แนวคิดหลักที่นี่คือ ไฟฟ้า. เธอคือผู้กำหนดประเภท พันธะเคมีระหว่างอะตอมกับคุณสมบัติของพันธะนี้
คือความสามารถของอะตอมในการดึงดูด (ค้าง) ภายนอก(วาเลนซ์) อิเล็กตรอน. อิเลคโตรเนกาติวีตี้ถูกกำหนดโดยระดับแรงดึงดูดของอิเล็กตรอนชั้นนอกที่มีต่อนิวเคลียส และขึ้นอยู่กับรัศมีของอะตอมและประจุของนิวเคลียสเป็นหลัก
อิเลคโตรเนกาติวีตี้เป็นเรื่องยากที่จะระบุได้อย่างชัดเจน L. Pauling รวบรวมตารางอิเลคโตรเนกาติวิตีสัมพัทธ์ (ขึ้นอยู่กับพลังงานพันธะของโมเลกุลไดอะตอมมิก) องค์ประกอบที่มีประจุไฟฟ้ามากที่สุดคือ ฟลูออรีนด้วยความหมาย 4 .
สิ่งสำคัญคือต้องทราบว่าใน แหล่งต่างๆคุณสามารถค้นหาสเกลและตารางค่าอิเลคโตรเนกาติวีตี้ต่างๆ ได้ สิ่งนี้ไม่ควรตื่นตระหนกเนื่องจากการก่อตัวของพันธะเคมีมีบทบาท อะตอม และมีค่าเท่ากันในทุกระบบ
หากอะตอมหนึ่งในพันธะเคมี A:B ดึงดูดอิเล็กตรอนแรงกว่า คู่อิเล็กตรอนจะเคลื่อนที่เข้าหาอะตอมนั้น ยิ่ง ความแตกต่างของอิเลคโตรเนกาติวีตี้อะตอม ยิ่งคู่อิเล็กตรอนเคลื่อนที่มากขึ้น
หากอิเลคโตรเนกาติวิตี้ของอะตอมที่มีปฏิสัมพันธ์เท่ากันหรือเท่ากันโดยประมาณ: อีโอ(เอ) µ อีโอ(บี)ดังนั้นคู่อิเล็กตรอนทั่วไปจะไม่เลื่อนไปที่อะตอมใดๆ: ตอบ: บี. การเชื่อมต่อนี้เรียกว่า โควาเลนต์ไม่มีขั้ว
หากอิเล็กโตรเนกาติวีตี้ของอะตอมที่มีปฏิสัมพันธ์แตกต่างกัน แต่ไม่มาก (ความแตกต่างของอิเล็กโทรเนกาติวีตี้จะอยู่ที่ประมาณ 0.4 ถึง 2: 0,4<ΔЭО<2 ) จากนั้นคู่อิเล็กตรอนจะถูกแทนที่ด้วยอะตอมตัวใดตัวหนึ่ง การเชื่อมต่อนี้เรียกว่า ขั้วโลกโควาเลนต์ .
หากอิเล็กโตรเนกาติวีตี้ของอะตอมที่มีปฏิสัมพันธ์แตกต่างกันอย่างมีนัยสำคัญ (ความแตกต่างของอิเล็กโทรเนกาติวีตี้มากกว่า 2: ΔEO>2) จากนั้นอิเล็กตรอนตัวหนึ่งจะถูกถ่ายโอนไปยังอะตอมอื่นเกือบทั้งหมดโดยมีการก่อตัว ไอออน. การเชื่อมต่อนี้เรียกว่า อิออน.
พันธะเคมีประเภทพื้นฐาน − โควาเลนต์, อิออนและ โลหะการสื่อสาร มาดูพวกเขากันดีกว่า
พันธะเคมีโควาเลนต์
พันธะโควาเลนต์ – มันคือพันธะเคมี , เกิดขึ้นเนื่องจาก การเกิดคู่อิเล็กตรอนร่วม A:B . ยิ่งกว่านั้นอีกสองอะตอม ทับซ้อนกันออร์บิทัลของอะตอม พันธะโควาเลนต์เกิดขึ้นจากอันตรกิริยาของอะตอมโดยมีค่าอิเลคโตรเนกาติวีตี้ต่างกันเล็กน้อย (โดยปกติ ระหว่างสองอโลหะ) หรืออะตอมของธาตุหนึ่ง
คุณสมบัติพื้นฐานของพันธะโควาเลนต์
- จุดสนใจ,
- ความอิ่มตัว,
- ขั้ว,
- ความสามารถในการโพลาไรซ์.
คุณสมบัติการยึดเกาะเหล่านี้มีอิทธิพลต่อคุณสมบัติทางเคมีและทางกายภาพของสาร
ทิศทางการสื่อสาร แสดงลักษณะโครงสร้างทางเคมีและรูปแบบของสาร มุมระหว่างพันธะทั้งสองเรียกว่ามุมพันธะ ตัวอย่างเช่น ในโมเลกุลของน้ำ มุมพันธะ H-O-H คือ 104.45 o ดังนั้นโมเลกุลของน้ำจึงมีขั้ว และในโมเลกุลมีเทน มุมพันธะ H-C-H คือ 108 o 28′

ความอิ่มตัว คือความสามารถของอะตอมในการสร้างพันธะเคมีโควาเลนต์จำนวนจำกัด เรียกว่าจำนวนพันธะที่อะตอมสามารถสร้างได้
ขั้วพันธะเกิดขึ้นเนื่องจากการกระจายความหนาแน่นของอิเล็กตรอนไม่เท่ากันระหว่างอะตอมสองอะตอมที่มีอิเลคโตรเนกาติวีตี้ต่างกัน พันธะโควาเลนต์แบ่งออกเป็นแบบมีขั้วและไม่มีขั้ว
ความสามารถในการโพลาไรซ์ การเชื่อมต่ออยู่ ความสามารถของพันธะอิเล็กตรอนในการเปลี่ยนแปลงภายใต้อิทธิพลของสนามไฟฟ้าภายนอก(โดยเฉพาะสนามไฟฟ้าของอนุภาคอื่น) ความสามารถในการโพลาไรซ์ขึ้นอยู่กับการเคลื่อนที่ของอิเล็กตรอน ยิ่งอิเล็กตรอนอยู่ห่างจากนิวเคลียสมากเท่าไรก็ยิ่งเคลื่อนที่ได้มากขึ้นเท่านั้น และด้วยเหตุนี้โมเลกุลจึงสามารถแบ่งขั้วได้มากขึ้น

พันธะเคมีโควาเลนต์ไม่มีขั้ว
พันธะโควาเลนต์มี 2 ประเภทคือ ขั้วโลกและ ไม่ใช่ขั้ว .
ตัวอย่าง . ลองพิจารณาโครงสร้างของโมเลกุลไฮโดรเจน H2 กัน อะตอมไฮโดรเจนแต่ละอะตอมในระดับพลังงานภายนอกจะมีอิเล็กตรอนที่ไม่มีการจับคู่ 1 ตัว ในการแสดงอะตอม เราใช้โครงสร้างลูอิส ซึ่งเป็นแผนภาพแสดงโครงสร้างของระดับพลังงานภายนอกของอะตอม เมื่ออิเล็กตรอนถูกระบุด้วยจุด แบบจำลองโครงสร้างจุดลิวอิสมีประโยชน์มากเมื่อทำงานกับองค์ประกอบของคาบที่สอง
ชม. + . ช = ช:ช
ดังนั้นโมเลกุลไฮโดรเจนจึงมีคู่อิเล็กตรอนร่วมกันหนึ่งคู่และมีพันธะเคมี H-H หนึ่งพันธะ คู่อิเล็กตรอนนี้ไม่ได้เลื่อนไปยังอะตอมไฮโดรเจนใดๆ เนื่องจาก อะตอมไฮโดรเจนมีอิเล็กโตรเนกาติวีตี้เท่ากัน การเชื่อมต่อนี้เรียกว่า โควาเลนต์ไม่มีขั้ว .

พันธะโควาเลนต์ไม่มีขั้ว (สมมาตร) เป็นพันธะโควาเลนต์ที่เกิดจากอะตอมที่มีอิเลคโตรเนกาติวีตี้เท่ากัน (โดยปกติจะเป็นอโลหะชนิดเดียวกัน) และด้วยเหตุนี้จึงมีการกระจายความหนาแน่นของอิเล็กตรอนสม่ำเสมอระหว่างนิวเคลียสของอะตอม
โมเมนต์ไดโพลของพันธะไม่มีขั้วคือ 0
ตัวอย่าง: H 2 (H-H), O 2 (O=O), S 8
พันธะเคมีขั้วโลกโควาเลนต์
พันธะขั้วโลกโควาเลนต์ คือพันธะโควาเลนต์ที่เกิดขึ้นระหว่าง อะตอมที่มีอิเล็กโทรเนกาติวีตี้ต่างกัน (โดยปกติ, อโลหะต่างๆ) และมีลักษณะเฉพาะ การกระจัดคู่อิเล็กตรอนที่ใช้ร่วมกันกับอะตอมที่มีอิเล็กโทรเนกาติตีมากขึ้น (โพลาไรเซชัน)
ความหนาแน่นของอิเล็กตรอนถูกเลื่อนไปที่อะตอมที่มีอิเล็กโตรเนกาติวีตีมากขึ้น ดังนั้น ประจุลบบางส่วน (δ-) จะปรากฏขึ้น และประจุบวกบางส่วน (δ+, เดลต้า +) จะปรากฏบนอะตอมที่มีอิเลคโตรเนกาติตีน้อยกว่า
ยิ่งความแตกต่างในอิเลคโตรเนกาติวีตี้ของอะตอมมากเท่าไรก็ยิ่งสูงขึ้นเท่านั้น ขั้วการเชื่อมต่อและอื่น ๆ โมเมนต์ไดโพล . แรงดึงดูดเพิ่มเติมกระทำระหว่างโมเลกุลข้างเคียงกับประจุที่มีเครื่องหมายตรงกันข้าม ซึ่งจะเพิ่มขึ้น ความแข็งแกร่งการสื่อสาร
ขั้วของพันธะส่งผลต่อคุณสมบัติทางกายภาพและเคมีของสารประกอบ กลไกการเกิดปฏิกิริยาและแม้กระทั่งการเกิดปฏิกิริยาของพันธะข้างเคียงนั้นขึ้นอยู่กับขั้วของพันธะ ขั้วของการเชื่อมต่อมักจะเป็นตัวกำหนด ขั้วของโมเลกุลและส่งผลโดยตรงต่อคุณสมบัติทางกายภาพ เช่น จุดเดือดและจุดหลอมเหลว ความสามารถในการละลายในตัวทำละลายที่มีขั้ว
ตัวอย่าง: HCl, CO 2, NH 3
กลไกการเกิดพันธะโควาเลนต์
พันธะเคมีโควาเลนต์เกิดขึ้นได้ 2 กลไก คือ
1. กลไกการแลกเปลี่ยน การก่อตัวของพันธะเคมีโควาเลนต์คือเมื่อแต่ละอนุภาคให้อิเล็กตรอนที่ไม่มีคู่หนึ่งตัวเพื่อสร้างคู่อิเล็กตรอนร่วม:
ก . + . บี= ก:บี
2. การเกิดพันธะโควาเลนต์เป็นกลไกที่อนุภาคตัวหนึ่งให้อิเล็กตรอนคู่เดียว และอีกอนุภาคหนึ่งทำให้เกิดวงโคจรที่ว่างสำหรับคู่อิเล็กตรอนนี้:
ตอบ: + บี= ก:บี

ในกรณีนี้ อะตอมตัวหนึ่งจะมีอิเล็กตรอนคู่เดียว ( ผู้บริจาค) และอะตอมอีกอะตอมหนึ่งจะมีวงโคจรว่างสำหรับคู่นั้น ( ผู้ยอมรับ). อันเป็นผลมาจากการก่อตัวของพันธะทั้งสองทำให้พลังงานของอิเล็กตรอนลดลงนั่นคือ สิ่งนี้เป็นประโยชน์ต่ออะตอม
พันธะโควาเลนต์ที่เกิดจากกลไกของผู้บริจาคและผู้รับ ไม่แตกต่างกันในคุณสมบัติจากพันธะโควาเลนต์อื่นที่เกิดจากกลไกการแลกเปลี่ยน การก่อตัวของพันธะโควาเลนต์โดยกลไกของผู้บริจาค-ผู้รับเป็นเรื่องปกติสำหรับอะตอมที่มีอิเล็กตรอนจำนวนมากที่ระดับพลังงานภายนอก (ผู้บริจาคอิเล็กตรอน) หรือในทางกลับกัน กับอิเล็กตรอนจำนวนน้อยมาก (ตัวรับอิเล็กตรอน) ความสามารถความจุของอะตอมมีรายละเอียดเพิ่มเติมในส่วนที่เกี่ยวข้อง
พันธะโควาเลนต์เกิดขึ้นจากกลไกของผู้บริจาค-ผู้รับ:
- ในโมเลกุล คาร์บอนมอนอกไซด์ CO(พันธะในโมเลกุลนั้นเป็นสามเท่า พันธะ 2 อันเกิดจากกลไกการแลกเปลี่ยน พันธะหนึ่งเกิดจากกลไกผู้บริจาคและผู้รับ): C≡O;
- วี แอมโมเนียมไอออน NH 4 + ในหน่วยไอออน เอมีนอินทรีย์ตัวอย่างเช่นในเมทิลแอมโมเนียมไอออน CH 3 -NH 2 + ;
- วี สารประกอบเชิงซ้อนพันธะเคมีระหว่างอะตอมกลางและหมู่ลิแกนด์ เช่น ในพันธะโซเดียมเตตระไฮดรอกโซอะลูมิเนต Na ระหว่างอะลูมิเนียมกับไฮดรอกไซด์ไอออน
- วี กรดไนตริกและเกลือของมัน- ไนเตรต: HNO 3, NaNO 3 ในสารประกอบไนโตรเจนอื่น ๆ

- ในโมเลกุล โอโซน O3.
ลักษณะพื้นฐานของพันธะโควาเลนต์
โดยทั่วไปพันธะโควาเลนต์จะเกิดขึ้นระหว่างอะตอมที่ไม่ใช่โลหะ ลักษณะสำคัญของพันธะโควาเลนต์คือ ความยาว พลังงาน ความหลากหลาย และทิศทาง
พันธะเคมีหลายหลาก
พันธะเคมีหลายหลาก - นี้ จำนวนคู่อิเล็กตรอนที่ใช้ร่วมกันระหว่างสองอะตอมในสารประกอบ. ความหลากหลายของพันธะสามารถกำหนดได้ง่ายมากจากค่าของอะตอมที่ก่อตัวเป็นโมเลกุล
ตัวอย่างเช่น ในโมเลกุลไฮโดรเจน H 2 พันธะหลายหลากคือ 1 เพราะ ไฮโดรเจนแต่ละตัวมีอิเล็กตรอนที่ไม่จับคู่เพียง 1 ตัวในระดับพลังงานภายนอก ดังนั้นจึงเกิดคู่อิเล็กตรอนที่ใช้ร่วมกันหนึ่งคู่
ในโมเลกุลออกซิเจน O 2 พันธะหลายหลากคือ 2 เพราะ แต่ละอะตอมที่ระดับพลังงานภายนอกจะมีอิเล็กตรอน 2 ตัวที่ไม่จับคู่: O=O
ในโมเลกุลไนโตรเจน N2 พันธะหลายหลากคือ 3 เพราะ ระหว่างแต่ละอะตอมจะมีอิเล็กตรอนที่ไม่จับคู่ 3 ตัวที่ระดับพลังงานภายนอก และอะตอมจะรวมกันเป็นคู่อิเล็กตรอนร่วม 3 คู่ N≡N
ความยาวพันธะโควาเลนต์
ความยาวพันธะเคมี
คือระยะห่างระหว่างศูนย์กลางของนิวเคลียสของอะตอมที่ก่อให้เกิดพันธะ ถูกกำหนดโดยวิธีทางกายภาพเชิงทดลอง ความยาวพันธะสามารถประมาณได้โดยประมาณโดยใช้กฎบวก ซึ่งความยาวพันธะในโมเลกุล AB มีค่าประมาณเท่ากับครึ่งหนึ่งของผลรวมของความยาวพันธะในโมเลกุล A 2 และ B 2: 
ความยาวของพันธะเคมีสามารถประมาณได้คร่าวๆ โดยรัศมีอะตอมสร้างความผูกพันหรือ ด้วยการสื่อสารที่หลากหลายถ้ารัศมีของอะตอมไม่แตกต่างกันมาก
เมื่อรัศมีของอะตอมที่สร้างพันธะเพิ่มขึ้น ความยาวของพันธะก็จะเพิ่มขึ้น
ตัวอย่างเช่น
เมื่อพันธะหลายหลากระหว่างอะตอมเพิ่มขึ้น (รัศมีอะตอมซึ่งไม่แตกต่างกันหรือแตกต่างกันเพียงเล็กน้อย) ความยาวของพันธะก็จะลดลง
ตัวอย่างเช่น . ในชุด: C–C, C=C, C≡C ความยาวพันธะจะลดลง
พลังงานการสื่อสาร
การวัดความแข็งแรงของพันธะเคมีคือพลังงานของพันธะ พลังงานการสื่อสาร ถูกกำหนดโดยพลังงานที่จำเป็นในการทำลายพันธะและกำจัดอะตอมที่ก่อตัวเป็นพันธะนั้นออกไปในระยะห่างที่ไกลกันอย่างไม่มีที่สิ้นสุด
พันธะโควาเลนต์ก็คือ ทนทานมากพลังงานมีตั้งแต่หลายสิบถึงหลายร้อย kJ/mol ยิ่งพลังงานพันธะสูง ความแข็งแรงของพันธะก็จะยิ่งมากขึ้น และในทางกลับกัน
ความแข็งแรงของพันธะเคมีขึ้นอยู่กับความยาวของพันธะ ขั้วของพันธะ และทวีคูณของพันธะ ยิ่งพันธะเคมีนานเท่าไรก็ยิ่งแตกง่ายเท่านั้น และยิ่งพลังงานพันธะต่ำลง ความแรงของพันธะก็จะยิ่งลดลงตามไปด้วย ยิ่งพันธะเคมีสั้นลงก็ยิ่งแข็งแรงขึ้น และพลังงานพันธะก็จะมากขึ้นตามไปด้วย
ตัวอย่างเช่นในชุดสารประกอบ HF, HCl, HBr จากซ้ายไปขวา ความแข็งแรงของพันธะเคมี ลดลง, เพราะ ความยาวการเชื่อมต่อเพิ่มขึ้น
พันธะเคมีไอออนิก

พันธะไอออนิก เป็นพันธะเคมีที่มีพื้นฐานมาจาก แรงดึงดูดทางไฟฟ้าสถิตของไอออน.
ไอออนเกิดขึ้นจากกระบวนการรับหรือบริจาคอิเล็กตรอนโดยอะตอม ตัวอย่างเช่น อะตอมของโลหะทุกชนิดกักเก็บอิเล็กตรอนจากระดับพลังงานภายนอกไว้อย่างอ่อน ดังนั้นอะตอมของโลหะจึงมีลักษณะเฉพาะคือ คุณสมบัติการบูรณะ- ความสามารถในการบริจาคอิเล็กตรอน

ตัวอย่าง. อะตอมโซเดียมประกอบด้วยอิเล็กตรอน 1 ตัวที่ระดับพลังงาน 3 อะตอมโซเดียมจะทำให้เกิด Na + ไอออนที่เสถียรกว่ามากโดยการยอมแพ้อย่างง่ายดาย โดยมีการจัดเรียงอิเล็กตรอนของนีออนก๊าซมีตระกูล Ne โซเดียมไอออนประกอบด้วยโปรตอน 11 ตัวและอิเล็กตรอนเพียง 10 ตัว ดังนั้นประจุรวมของไอออนคือ -10+11 = +1:
+11นา) 2 ) 8 ) 1 - 1e = +11 นา +) 2 ) 8
ตัวอย่าง. อะตอมของคลอรีนในระดับพลังงานภายนอกประกอบด้วยอิเล็กตรอน 7 ตัว เพื่อให้ได้โครงร่างของอะตอมอาร์กอนเฉื่อยที่เสถียร Ar คลอรีนจำเป็นต้องได้รับอิเล็กตรอน 1 ตัว หลังจากเติมอิเล็กตรอนจะเกิดไอออนคลอรีนที่เสถียรซึ่งประกอบด้วยอิเล็กตรอน ประจุรวมของไอออนคือ -1:
+17Cl) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
บันทึก:
- คุณสมบัติของไอออนแตกต่างจากคุณสมบัติของอะตอม!
- ไม่เพียงแต่ไอออนที่เสถียรจะก่อตัวเท่านั้น อะตอมแต่ยัง กลุ่มอะตอม. ตัวอย่างเช่น: แอมโมเนียมไอออน NH 4 +, ซัลเฟตไอออน SO 4 2- ฯลฯ พันธะเคมีที่เกิดจากไอออนดังกล่าวก็ถือเป็นไอออนิกเช่นกัน
- พันธะไอออนิกมักเกิดขึ้นระหว่างกัน โลหะและ อโลหะ(กลุ่มที่ไม่ใช่โลหะ);
ไอออนที่เกิดขึ้นจะถูกดึงดูดเนื่องจากแรงดึงดูดทางไฟฟ้า: Na + Cl -, Na 2 + SO 4 2-
ให้เราสรุปด้วยสายตา ความแตกต่างระหว่างชนิดของพันธะโควาเลนต์และไอออนิก:


การเชื่อมต่อโลหะ คือความเชื่อมโยงที่เกิดขึ้นค่อนข้างมาก อิเล็กตรอนอิสระระหว่าง ไอออนของโลหะกลายเป็นโครงตาข่ายคริสตัล
อะตอมของโลหะมักจะอยู่ที่ระดับพลังงานภายนอก หนึ่งถึงสามอิเล็กตรอน. ตามกฎแล้วรัศมีของอะตอมโลหะมีขนาดใหญ่ - ดังนั้นอะตอมของโลหะซึ่งแตกต่างจากอโลหะจึงยอมให้อิเล็กตรอนชั้นนอกของพวกมันค่อนข้างง่ายเช่น เป็นตัวรีดิวซ์ที่รุนแรง.
โดยการบริจาคอิเล็กตรอน อะตอมของโลหะจะกลายเป็น ไอออนที่มีประจุบวก . อิเล็กตรอนที่แยกออกมานั้นค่อนข้างอิสระ กำลังเคลื่อนไหวระหว่างไอออนโลหะที่มีประจุบวก ระหว่างอนุภาคเหล่านี้ มีการเชื่อมต่อเกิดขึ้น, เพราะ อิเล็กตรอนที่ใช้ร่วมกันจับไอออนบวกของโลหะที่จัดเรียงเป็นชั้น ๆ กัน จึงสร้างความเข้มแข็งได้พอสมควร ตาข่ายคริสตัลโลหะ . ในกรณีนี้อิเล็กตรอนจะเคลื่อนที่อย่างโกลาหลอย่างต่อเนื่องเช่น อะตอมที่เป็นกลางใหม่และไอออนบวกใหม่จะปรากฏขึ้นอย่างต่อเนื่อง

ปฏิสัมพันธ์ระหว่างโมเลกุล
แยกจากกัน มันคุ้มค่าที่จะพิจารณาปฏิสัมพันธ์ที่เกิดขึ้นระหว่างแต่ละโมเลกุลในสาร - ปฏิสัมพันธ์ระหว่างโมเลกุล . ปฏิสัมพันธ์ระหว่างโมเลกุลเป็นปฏิสัมพันธ์ประเภทหนึ่งระหว่างอะตอมที่เป็นกลางซึ่งไม่มีพันธะโควาเลนต์ใหม่เกิดขึ้น พลังแห่งปฏิสัมพันธ์ระหว่างโมเลกุลถูกค้นพบโดย Van der Waals ในปี 1869 และตั้งชื่อตามเขา กองกำลังฟาน ดาร์ วาลส์. กองกำลังของ Van der Waals แบ่งออกเป็น ปฐมนิเทศ, การเหนี่ยวนำ และ กระจายตัว . พลังงานของปฏิกิริยาระหว่างโมเลกุลนั้นน้อยกว่าพลังงานของพันธะเคมีมาก
แรงดึงดูดของการปฐมนิเทศ เกิดขึ้นระหว่างโมเลกุลขั้วโลก (ปฏิสัมพันธ์ระหว่างไดโพล-ไดโพล) แรงเหล่านี้เกิดขึ้นระหว่างโมเลกุลขั้วโลก ปฏิสัมพันธ์แบบอุปนัย คืออันตรกิริยาระหว่างโมเลกุลที่มีขั้วกับโมเลกุลที่ไม่มีขั้ว โมเลกุลที่ไม่มีขั้วจะถูกโพลาไรซ์เนื่องจากการกระทำของขั้วหนึ่ง ซึ่งทำให้เกิดแรงดึงดูดของไฟฟ้าสถิตเพิ่มเติม
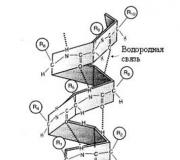
ปฏิสัมพันธ์ระหว่างโมเลกุลชนิดพิเศษคือพันธะไฮโดรเจน - สิ่งเหล่านี้เป็นพันธะเคมีระหว่างโมเลกุล (หรือภายในโมเลกุล) ที่เกิดขึ้นระหว่างโมเลกุลที่มีพันธะโควาเลนต์ที่มีขั้วสูง - H-F, H-O หรือ H-N. หากมีพันธะดังกล่าวในโมเลกุลก็จะมีพันธะระหว่างโมเลกุล พลังดึงดูดเพิ่มเติม .
กลไกการศึกษา พันธะไฮโดรเจนเป็นไฟฟ้าสถิตบางส่วนและเป็นผู้รับบริจาคบางส่วน ในกรณีนี้ ผู้บริจาคคู่อิเล็กตรอนคืออะตอมขององค์ประกอบที่มีอิเล็กโตรเนกาติตีอย่างแรง (F, O, N) และตัวรับคืออะตอมไฮโดรเจนที่เชื่อมต่อกับอะตอมเหล่านี้ พันธะไฮโดรเจนมีลักษณะเฉพาะคือ จุดสนใจ ในอวกาศและ ความอิ่มตัว
พันธะไฮโดรเจนสามารถระบุได้ด้วยจุด: H ··· O. ยิ่งอิเล็กโตรเนกาติวีตี้ของอะตอมที่เชื่อมต่อกับไฮโดรเจนมากขึ้นและขนาดที่เล็กลง พันธะไฮโดรเจนก็จะยิ่งแข็งแกร่งขึ้น เป็นเรื่องปกติสำหรับการเชื่อมต่อเป็นหลัก ฟลูออรีนกับไฮโดรเจน เช่นเดียวกับการ ออกซิเจนและไฮโดรเจน , น้อย ไนโตรเจนกับไฮโดรเจน .

พันธะไฮโดรเจนเกิดขึ้นระหว่างสารต่อไปนี้:
— ไฮโดรเจนฟลูออไรด์ HF(ก๊าซ, สารละลายไฮโดรเจนฟลูออไรด์ในน้ำ - กรดไฮโดรฟลูออริก), น้ำ H 2 O (ไอน้ำ น้ำแข็ง น้ำของเหลว):
— สารละลายแอมโมเนียและเอมีนอินทรีย์- ระหว่างแอมโมเนียกับโมเลกุลของน้ำ
— สารประกอบอินทรีย์ที่มีพันธะ O-H หรือ N-H: แอลกอฮอล์, กรดคาร์บอกซิลิก, เอมีน, กรดอะมิโน, ฟีนอล, อะนิลีนและอนุพันธ์ของมัน, โปรตีน, สารละลายคาร์โบไฮเดรต - มอนอแซ็กคาไรด์และไดแซ็กคาไรด์
พันธะไฮโดรเจนส่งผลต่อคุณสมบัติทางกายภาพและเคมีของสาร ดังนั้นแรงดึงดูดเพิ่มเติมระหว่างโมเลกุลทำให้สารเดือดได้ยาก สารที่มีพันธะไฮโดรเจนมีจุดเดือดเพิ่มขึ้นผิดปกติ
ตัวอย่างเช่น ตามกฎแล้วเมื่อน้ำหนักโมเลกุลเพิ่มขึ้นจะสังเกตการเพิ่มขึ้นของจุดเดือดของสาร อย่างไรก็ตามในสารหลายชนิด H 2 O-H 2 S-H 2 Se-H 2 Teเราไม่สังเกตการเปลี่ยนแปลงเชิงเส้นของจุดเดือด

กล่าวคือ ณ จุดเดือดของน้ำสูงผิดปกติ - ไม่น้อยกว่า -61 o C ตามที่เส้นตรงแสดงให้เราเห็น แต่มากกว่านั้น +100 o C ความผิดปกตินี้อธิบายได้จากการมีพันธะไฮโดรเจนระหว่างโมเลกุลของน้ำ ดังนั้นภายใต้สภาวะปกติ (0-20 o C) น้ำจึงเป็น ของเหลวตามสถานะเฟส
และการสื่อสารแบบสองอิเล็กตรอนสามจุดศูนย์กลาง
เมื่อคำนึงถึงการตีความทางสถิติของฟังก์ชันคลื่น M. Born ความหนาแน่นของความน่าจะเป็นในการค้นหาอิเล็กตรอนที่มีพันธะจะกระจุกตัวอยู่ในช่องว่างระหว่างนิวเคลียสของโมเลกุล (รูปที่ 1) ทฤษฎีการผลักกันของคู่อิเล็กตรอนพิจารณามิติทางเรขาคณิตของคู่เหล่านี้ ดังนั้น สำหรับองค์ประกอบของแต่ละคาบ จะมีรัศมีเฉลี่ยของคู่อิเล็กตรอน (Å):
0.6 สำหรับองค์ประกอบจนถึงนีออน 0.75 สำหรับองค์ประกอบจนถึงอาร์กอน 0.75 สำหรับองค์ประกอบจนถึงคริปทอน และ 0.8 สำหรับองค์ประกอบจนถึงซีนอน
คุณสมบัติเฉพาะของพันธะโควาเลนต์
คุณสมบัติเฉพาะของพันธะโควาเลนต์ - ทิศทาง, ความอิ่มตัว, ความเป็นขั้ว, ความสามารถในการโพลาไรซ์ - กำหนดคุณสมบัติทางเคมีและทางกายภาพของสารประกอบ
- ทิศทางของการเชื่อมต่อถูกกำหนดโดยโครงสร้างโมเลกุลของสารและรูปทรงเรขาคณิตของโมเลกุล
มุมระหว่างพันธะทั้งสองเรียกว่ามุมพันธะ
- ความอิ่มตัวคือความสามารถของอะตอมในการสร้างพันธะโควาเลนต์ในจำนวนที่จำกัด จำนวนพันธะที่เกิดจากอะตอมจะถูกจำกัดด้วยจำนวนออร์บิทัลอะตอมด้านนอก
- ความเป็นขั้วของพันธะเกิดจากการแจกแจงความหนาแน่นของอิเล็กตรอนไม่เท่ากันเนื่องจากความแตกต่างของอิเลคโตรเนกาติวีตี้ของอะตอม
บนพื้นฐานนี้พันธะโควาเลนต์จะถูกแบ่งออกเป็นแบบไม่มีขั้วและแบบขั้ว (ไม่มีขั้ว - โมเลกุลไดอะตอมมิกประกอบด้วยอะตอมที่เหมือนกัน (H 2, Cl 2, N 2) และเมฆอิเล็กตรอนของแต่ละอะตอมมีการกระจายแบบสมมาตรสัมพันธ์กับอะตอมเหล่านี้ ; ขั้วโลก - โมเลกุลไดอะตอมมิกประกอบด้วยอะตอมขององค์ประกอบทางเคมีที่แตกต่างกัน และเมฆอิเล็กตรอนทั่วไปเลื่อนไปทางอะตอมใดอะตอมหนึ่งซึ่งทำให้เกิดความไม่สมดุลในการกระจายประจุไฟฟ้าในโมเลกุลทำให้เกิดโมเมนต์ไดโพลของโมเลกุล)
- ความสามารถในการโพลาไรซ์ของพันธะจะแสดงออกในการแทนที่ของพันธะอิเล็กตรอนภายใต้อิทธิพลของสนามไฟฟ้าภายนอก รวมถึงสนามไฟฟ้าของอนุภาคอื่นที่ทำปฏิกิริยาด้วย ความสามารถในการโพลาไรซ์ถูกกำหนดโดยการเคลื่อนที่ของอิเล็กตรอน ความเป็นขั้วและความสามารถเชิงขั้วของพันธะโควาเลนต์จะเป็นตัวกำหนดปฏิกิริยาของโมเลกุลต่อสารรีเอเจนต์ที่มีขั้ว
อย่างไรก็ตาม แอล. พอลิง ผู้ได้รับรางวัลโนเบลถึงสองครั้ง ชี้ให้เห็นว่า “ในโมเลกุลบางชนิดมีพันธะโควาเลนต์เนื่องจากอิเล็กตรอนหนึ่งหรือสามตัวแทนที่จะเป็นคู่สามัญ” พันธะเคมีหนึ่งอิเล็กตรอนเกิดขึ้นในโมเลกุลไฮโดรเจนไอออน H 2 +
โมเลกุลไฮโดรเจนไอออน H2+ ประกอบด้วยโปรตอนสองตัวและอิเล็กตรอนหนึ่งตัว อิเล็กตรอนตัวเดียวของระบบโมเลกุลจะชดเชยแรงผลักไฟฟ้าสถิตของโปรตอนสองตัวและคงไว้ที่ระยะห่าง 1.06 Å (ความยาวของพันธะเคมี H 2+) จุดศูนย์กลางความหนาแน่นของอิเล็กตรอนของเมฆอิเล็กตรอนของระบบโมเลกุลนั้นอยู่ห่างจากโปรตอนทั้งสองตัวเท่ากันที่รัศมีบอร์ α 0 = 0.53 A และเป็นจุดศูนย์กลางของความสมมาตรของโมเลกุลไฮโดรเจนไอออน H 2 + .
ประวัติความเป็นมาของคำนี้
คำว่า "พันธะโควาเลนต์" ได้รับการประกาศเกียรติคุณครั้งแรกโดย Irving Langmuir ผู้ได้รับรางวัลโนเบลในปี 1919 คำนี้หมายถึงพันธะเคมีเนื่องจากการครอบครองอิเล็กตรอนร่วมกัน ซึ่งตรงกันข้ามกับพันธะโลหะซึ่งมีอิเล็กตรอนเป็นอิสระ หรือพันธะไอออนิกซึ่งอะตอมตัวหนึ่งปล่อยอิเล็กตรอนและกลายเป็นไอออนบวก และ อีกอะตอมหนึ่งรับอิเล็กตรอนและกลายเป็นไอออน
การสื่อสารการศึกษา
พันธะโควาเลนต์เกิดขึ้นจากอิเล็กตรอนคู่หนึ่งที่ใช้ร่วมกันระหว่างสองอะตอม และอิเล็กตรอนเหล่านี้จะต้องอยู่ในวงโคจรที่เสถียรสองตัว โดยหนึ่งวงมาจากแต่ละอะตอม
A + + B → A: B
จากการขัดเกลาทางสังคม อิเล็กตรอนจึงเกิดระดับพลังงานที่เต็มเปี่ยม พันธะจะเกิดขึ้นหากพลังงานรวมในระดับนี้น้อยกว่าในสถานะเริ่มต้น (และพลังงานที่แตกต่างกันจะไม่มีอะไรมากไปกว่าพลังงานพันธะ)
ตามทฤษฎีของออร์บิทัลโมเลกุล การทับซ้อนกันของออร์บิทัลของอะตอม 2 อัน ในกรณีที่ง่ายที่สุดจะทำให้เกิดการก่อตัวของออร์บิทัลโมเลกุล 2 อัน (MO): การเชื่อมโยง MOและ ป้องกันการผูกมัด (คลาย) MO. อิเล็กตรอนที่ใช้ร่วมกันจะอยู่ที่พันธะพลังงานที่ต่ำกว่า MO
การเกิดพันธะระหว่างการรวมตัวใหม่ของอะตอม
อย่างไรก็ตาม กลไกของการมีปฏิสัมพันธ์ระหว่างอะตอมยังไม่ทราบมาเป็นเวลานาน เฉพาะในปี 1930 F. London ได้เปิดตัวแนวคิดเรื่องแรงดึงดูดการกระจายตัว - ปฏิสัมพันธ์ระหว่างไดโพลที่เกิดขึ้นทันทีและเหนี่ยวนำ (เหนี่ยวนำ) ปัจจุบันแรงดึงดูดที่เกิดจากปฏิสัมพันธ์ระหว่างไดโพลไฟฟ้าที่ผันผวนของอะตอมและโมเลกุลเรียกว่า "แรงลอนดอน"
พลังงานของการโต้ตอบดังกล่าวเป็นสัดส่วนโดยตรงกับกำลังสองของความสามารถในการโพลาไรซ์ทางอิเล็กทรอนิกส์ α และแปรผกผันกับระยะห่างระหว่างอะตอมหรือโมเลกุลสองอะตอมถึงกำลังที่หก
การสร้างพันธะโดยกลไกผู้บริจาคและผู้รับ
นอกเหนือจากกลไกที่เป็นเนื้อเดียวกันของการสร้างพันธะโควาเลนต์ที่อธิบายไว้ในส่วนก่อนหน้าแล้ว ยังมีกลไกที่ต่างกัน - ปฏิกิริยาของไอออนที่มีประจุตรงข้าม - H + โปรตอนและไฮโดรเจนไอออนลบ H - เรียกว่าไฮไดรด์ไอออน:
เอช + + เอช - → เอช 2
เมื่อไอออนเข้าใกล้ เมฆอิเล็กตรอนสองตัว (คู่อิเล็กตรอน) ของไฮไดรด์ไอออนจะถูกดึงดูดเข้ากับโปรตอนและท้ายที่สุดก็กลายเป็นเรื่องปกติในนิวเคลียสของไฮโดรเจนทั้งสอง กล่าวคือ มันจะกลายเป็นคู่อิเล็กตรอนที่มีพันธะ อนุภาคที่จ่ายคู่อิเล็กตรอนเรียกว่าผู้บริจาค และอนุภาคที่รับคู่อิเล็กตรอนนี้เรียกว่าตัวรับ กลไกการเกิดพันธะโควาเลนต์นี้เรียกว่าผู้บริจาค-ผู้รับ
เอช + + เอช 2 โอ → เอช 3 โอ +
โปรตอนโจมตีคู่อิเล็กตรอนเดี่ยวของโมเลกุลของน้ำ และก่อให้เกิดไอออนบวกที่เสถียรซึ่งมีอยู่ในสารละลายกรดที่เป็นน้ำ
ในทำนองเดียวกัน โปรตอนจะถูกเติมเข้าไปในโมเลกุลแอมโมเนียเพื่อสร้างแอมโมเนียมไอออนบวกที่ซับซ้อน:
NH 3 + H + → NH 4 +
ด้วยวิธีนี้ (ตามกลไกของผู้บริจาคและผู้รับของการสร้างพันธะโควาเลนต์) จะได้สารประกอบหัวหอมขนาดใหญ่ซึ่งรวมถึงแอมโมเนียม, ออกโซเนียม, ฟอสโฟเนียม, ซัลโฟเนียมและสารประกอบอื่น ๆ
โมเลกุลไฮโดรเจนสามารถทำหน้าที่เป็นผู้บริจาคคู่อิเล็กตรอนซึ่งเมื่อสัมผัสกับโปรตอนจะนำไปสู่การก่อตัวของโมเลกุลไฮโดรเจนไอออน H 3 +:
ชม 2 + ชม + → ชม 3 +
คู่อิเล็กตรอนพันธะของโมเลกุลไฮโดรเจนไอออน H 3 + เป็นของโปรตอนสามตัวพร้อมกัน
ประเภทของพันธะโควาเลนต์
พันธะเคมีโควาเลนต์มีสามประเภท ซึ่งมีกลไกการก่อตัวที่แตกต่างกัน:
1. พันธะโควาเลนต์อย่างง่าย. สำหรับการก่อตัว แต่ละอะตอมจะให้อิเล็กตรอนที่ไม่มีการจับคู่หนึ่งตัว เมื่อเกิดพันธะโควาเลนต์อย่างง่าย ประจุอย่างเป็นทางการของอะตอมยังคงไม่เปลี่ยนแปลง
- หากอะตอมที่สร้างพันธะโควาเลนต์อย่างง่ายเท่ากัน ประจุที่แท้จริงของอะตอมในโมเลกุลก็จะเท่ากันเช่นกัน เนื่องจากอะตอมที่สร้างพันธะจะมีคู่อิเล็กตรอนร่วมกันเท่ากัน การเชื่อมต่อนี้เรียกว่า พันธะโควาเลนต์ที่ไม่มีขั้ว. สารเชิงเดี่ยวมีความเชื่อมโยงกัน เช่น 2, 2, 2 แต่ไม่เพียงแต่อโลหะประเภทเดียวกันเท่านั้นที่สามารถสร้างพันธะโควาเลนต์ไม่มีขั้วได้ องค์ประกอบที่ไม่ใช่โลหะซึ่งอิเล็กโตรเนกาติวีตี้มีความสำคัญเท่ากันก็สามารถสร้างพันธะโควาเลนต์ไม่มีขั้วได้ ตัวอย่างเช่น ในโมเลกุล PH 3 พันธะจะเป็นโควาเลนต์ไม่มีขั้ว เนื่องจาก EO ของไฮโดรเจนเท่ากับ EO ของฟอสฟอรัส
- หากอะตอมต่างกัน ระดับการครอบครองของอิเล็กตรอนคู่ที่ใช้ร่วมกันจะถูกกำหนดโดยความแตกต่างในอิเล็กโตรเนกาติวีตี้ของอะตอม อะตอมที่มีค่าอิเลคโตรเนกาติวีตี้มากกว่าจะดึงดูดอิเล็กตรอนคู่ที่มีพันธะเข้าหาตัวมันเองอย่างแรงยิ่งขึ้น และประจุที่แท้จริงของมันก็จะกลายเป็นลบ อะตอมที่มีค่าอิเล็กโตรเนกาติวีตี้ต่ำกว่าจะได้ประจุบวกที่มีขนาดเท่ากัน หากสารประกอบเกิดขึ้นระหว่างอโลหะสองชนิดที่แตกต่างกัน สารประกอบดังกล่าวจะถูกเรียกว่า พันธะขั้วโลกโควาเลนต์.
ในโมเลกุลเอทิลีน C 2 H 4 มีพันธะคู่ CH 2 = CH 2 สูตรอิเล็กทรอนิกส์: H:C::C:H นิวเคลียสของอะตอมเอทิลีนทั้งหมดอยู่ในระนาบเดียวกัน เมฆอิเล็กตรอนสามก้อนของแต่ละอะตอมของคาร์บอนก่อให้เกิดพันธะโควาเลนต์สามพันธะกับอะตอมอื่น ๆ ในระนาบเดียวกัน (โดยมีมุมระหว่างพันธะประมาณ 120°) เมฆของเวเลนซ์อิเล็กตรอนตัวที่สี่ของอะตอมคาร์บอนตั้งอยู่ด้านบนและด้านล่างระนาบของโมเลกุล เมฆอิเล็กตรอนของอะตอมคาร์บอนทั้งสองซึ่งทับซ้อนกันบางส่วนด้านบนและด้านล่างระนาบของโมเลกุล ก่อให้เกิดพันธะที่สองระหว่างอะตอมของคาร์บอน พันธะโควาเลนต์แรกที่แข็งแกร่งกว่าระหว่างอะตอมของคาร์บอนเรียกว่าพันธะ σ; พันธะโควาเลนต์ที่สองที่อ่อนกว่าเรียกว่า π (\displaystyle \pi )- การสื่อสาร.
ข้อมูลเกี่ยวกับพลังงานไอออไนเซชัน (IE), PEI และองค์ประกอบของโมเลกุลที่เสถียร - ค่าจริงและการเปรียบเทียบ - ทั้งอะตอมอิสระและอะตอมที่จับกันเป็นโมเลกุลช่วยให้เราเข้าใจว่าอะตอมก่อตัวเป็นโมเลกุลผ่านกลไกของพันธะโควาเลนต์ได้อย่างไร
พันธะโควาเลนต์- (จากภาษาละติน “co” รวมกันและ “vales” ที่มีแรง) (พันธะโฮมโอโพลาร์) พันธะเคมีระหว่างอะตอมสองอะตอมที่เกิดขึ้นเมื่ออิเล็กตรอนของอะตอมเหล่านี้ถูกใช้ร่วมกัน อะตอมในโมเลกุลของก๊าซเชิงเดี่ยวเชื่อมต่อกันด้วยพันธะโควาเลนต์ พันธะที่มีอิเล็กตรอนคู่หนึ่งใช้ร่วมกันเรียกว่าพันธะเดี่ยว นอกจากนี้ยังมีพันธะคู่และพันธะสามด้วย
ลองดูตัวอย่างเล็กๆ น้อยๆ เพื่อดูว่าเราจะใช้กฎของเราในการกำหนดจำนวนพันธะเคมีโควาเลนต์ที่อะตอมสามารถสร้างขึ้นได้อย่างไร ถ้าเราทราบจำนวนอิเล็กตรอนในเปลือกนอกของอะตอมที่กำหนดและประจุบนนิวเคลียสของมัน ประจุของนิวเคลียสและจำนวนอิเล็กตรอนในเปลือกนอกถูกกำหนดโดยการทดลองและรวมอยู่ในตารางองค์ประกอบ
การคำนวณจำนวนพันธะโควาเลนต์ที่เป็นไปได้
ตัวอย่างเช่น ลองนับจำนวนพันธะโควาเลนต์ที่สามารถสร้างโซเดียมได้ ( นา)อลูมิเนียม (อัล)ฟอสฟอรัส (ป)และคลอรีน ( ซีแอล). โซเดียม ( นา)และอลูมิเนียม ( อัล)มีอิเล็กตรอน 1 และ 3 ตัวในเปลือกนอกตามลำดับและตามกฎข้อแรก (สำหรับกลไกของการสร้างพันธะโควาเลนต์จะใช้อิเล็กตรอนหนึ่งตัวในเปลือกนอก) พวกมันสามารถสร้าง: โซเดียม (นา)- 1 และอลูมิเนียม ( อัล)- 3 พันธะโควาเลนต์ หลังจากเกิดพันธะ จำนวนอิเล็กตรอนในเปลือกนอกของโซเดียม ( นา)และอลูมิเนียม ( อัล)เท่ากับ 2 และ 6 ตามลำดับ กล่าวคือน้อยกว่าจำนวนสูงสุด (8) สำหรับอะตอมเหล่านี้ ฟอสฟอรัส ( ป)และคลอรีน ( ซีแอล)มีอิเล็กตรอน 5 และ 7 ตัวบนเปลือกนอกตามลำดับ และตามกฎข้อที่สองข้างต้น พวกมันสามารถสร้างพันธะโควาเลนต์ได้ 5 และ 7 ตัว ตามกฎข้อที่สี่ การก่อตัวของพันธะโควาเลนต์ จำนวนอิเล็กตรอนบนเปลือกนอกของอะตอมเหล่านี้จะเพิ่มขึ้น 1 ตามกฎข้อที่หก เมื่อมีการสร้างพันธะโควาเลนต์ จำนวนอิเล็กตรอนบนเปลือกนอก ของอะตอมที่ถูกพันธะต้องไม่เกิน 8 กล่าวคือ ฟอสฟอรัส ( ป)สามารถสร้างพันธะได้เพียง 3 พันธะ (8-5 = 3) ในขณะที่คลอรีน ( ซีแอล)สามารถสร้างได้เพียงอันเดียว (8-7 = 1)
ตัวอย่าง:จากการวิเคราะห์ เราค้นพบว่าสารบางชนิดประกอบด้วยอะตอมของโซเดียม (นา)และคลอรีน ( ซีแอล). เมื่อทราบถึงความสม่ำเสมอของกลไกการก่อตัวของพันธะโควาเลนต์เราสามารถพูดได้ว่า โซเดียม ( นา) สามารถสร้างพันธะโคเวเลนต์ได้เพียง 1 พันธะเท่านั้น ดังนั้น เราสามารถสรุปได้ว่าแต่ละอะตอมของโซเดียม ( นา)จับกับอะตอมของคลอรีน ( ซีแอล)ผ่านพันธะโควาเลนต์ในสารนี้ และสารนี้ประกอบด้วยโมเลกุลของอะตอม โซเดียมคลอไรด์. สูตรโครงสร้างของโมเลกุลนี้: Na-Clในที่นี้ขีดกลาง (-) หมายถึงพันธะโควาเลนต์ สูตรอิเล็กทรอนิกส์ของโมเลกุลนี้สามารถแสดงได้ดังนี้:
. .
นา:Cl:
. .
ตามสูตรอิเล็กทรอนิกส์ บนเปลือกนอกของอะตอมโซเดียม ( นา)วี โซเดียมคลอไรด์มีอิเล็กตรอน 2 ตัว และที่เปลือกนอกของอะตอมคลอรีน ( ซีแอล)มีอิเล็กตรอน 8 ตัว ในสูตรนี้ อิเล็กตรอน (จุด) ระหว่างอะตอมโซเดียม ( นา)และ
คลอรีน (ซีแอล)เป็นพันธะอิเล็กตรอน เนื่องจากค่า PEI ของคลอรีน ( ซีแอล)มีค่าเท่ากับ 13 eV และสำหรับโซเดียม (นา)มีค่าเท่ากับ 5.14 eV ซึ่งเป็นคู่พันธะของอิเล็กตรอนที่อยู่ใกล้กับอะตอมมากขึ้น Clมากกว่าที่จะเป็นอะตอม นา. หากพลังงานไอออไนเซชันของอะตอมที่สร้างโมเลกุลนั้นแตกต่างกันมาก พันธะที่เกิดขึ้นก็จะเป็น ขั้วโลกพันธะโควาเลนต์
ลองพิจารณาอีกกรณีหนึ่ง จากการวิเคราะห์ เราค้นพบว่าสารบางชนิดประกอบด้วยอะตอมของอะลูมิเนียม ( อัล)และอะตอมของคลอรีน ( ซีแอล). ในอลูมิเนียม ( อัล)มีอิเล็กตรอน 3 ตัวอยู่ในเปลือกนอก ดังนั้นจึงสามารถสร้างพันธะเคมีโควาเลนต์ได้ 3 ตัวในขณะที่ คลอรีน (ซีแอล)ดังเช่นในกรณีก่อนหน้านี้ สามารถสร้างพันธะได้เพียง 1 พันธะเท่านั้น สารนี้จะแสดงเป็น AlCl3และสูตรอิเล็กทรอนิกส์สามารถแสดงได้ดังนี้:
รูปที่ 3.1. สูตรอิเล็กทรอนิกส์AlCl 3
ซึ่งมีสูตรโครงสร้างดังนี้
แคล - อัล - แคล
Cl
สูตรอิเล็กทรอนิกส์นี้แสดงให้เห็นว่า AlCl3บนเปลือกนอกของอะตอมคลอรีน ( Cl) มีอิเล็กตรอน 8 ตัว ในขณะที่เปลือกนอกของอะตอมอะลูมิเนียม ( อัล)มี 6 ตัว ตามกลไกการก่อตัวของพันธะโควาเลนต์อิเล็กตรอนทั้งสองที่มีพันธะ (หนึ่งตัวจากแต่ละอะตอม) จะไปที่เปลือกนอกของอะตอมที่ถูกพันธะ
พันธะโควาเลนต์หลายตัว
อะตอมที่มีอิเล็กตรอนมากกว่าหนึ่งตัวในเปลือกนอกไม่สามารถสร้างพันธะโควาเลนต์ได้หลายพันธะต่อกัน การเชื่อมต่อดังกล่าวเรียกว่าหลายรายการ (บ่อยกว่านั้น) ทวีคูณ) การเชื่อมต่อ ตัวอย่างของพันธะดังกล่าวคือพันธะของโมเลกุลไนโตรเจน ( เอ็น= เอ็น) และออกซิเจน ( โอ=โอ).
พันธะที่เกิดขึ้นเมื่ออะตอมเดี่ยวมารวมกันเรียกว่า พันธะโควาเลนต์แบบโฮโมอะตอมมิก เช่นถ้าอะตอมต่างกันก็จะเรียกว่าพันธะ พันธะโควาเลนต์เฮเทอโรอะตอม[คำนำหน้าภาษากรีก "homo" และ "hetero" ตามลำดับแปลว่าเหมือนและแตกต่าง]
ลองจินตนาการดูว่าจริงๆ แล้วโมเลกุลที่มีอะตอมคู่กันมีลักษณะเป็นอย่างไร โมเลกุลที่ง่ายที่สุดที่มีอะตอมคู่กันคือโมเลกุลไฮโดรเจน
ไม่ต้องสงสัยเลยว่าเคมีเป็นวิทยาศาสตร์ที่ค่อนข้างซับซ้อนและมีความหลากหลาย ปฏิกิริยา รีเอเจนต์ สารเคมี และคำศัพท์ที่ซับซ้อนและน่าสับสนอื่นๆ มากมาย ล้วนมีปฏิสัมพันธ์ซึ่งกันและกัน แต่สิ่งสำคัญคือเราจัดการกับวิชาเคมีทุกวัน ไม่ว่าเราจะฟังครูในชั้นเรียนและเรียนรู้เนื้อหาใหม่ๆ หรือชงชา ซึ่งโดยทั่วไปก็เป็นกระบวนการทางเคมีเช่นกัน
ก็สรุปได้ว่า คุณเพียงแค่ต้องรู้เคมีการทำความเข้าใจและการรู้ว่าโลกของเราหรือบางส่วนของมันทำงานอย่างไรนั้นน่าสนใจและยังมีประโยชน์อีกด้วย
ตอนนี้เราต้องจัดการกับคำเช่นพันธะโควาเลนต์ซึ่งอาจเป็นได้ทั้งแบบมีขั้วหรือไม่มีขั้วก็ได้ อย่างไรก็ตาม คำว่า "โควาเลนต์" นั้นมาจากภาษาละตินว่า "co" - รวมกันและ "vales" - มีพลัง
การปรากฏตัวของคำ
เริ่มจากความจริงที่ว่า คำว่า "โควาเลนต์" ถูกนำมาใช้ครั้งแรกในปี 1919 โดย Irving Langmuir -ผู้ได้รับรางวัลโนเบล. แนวคิดของ "โควาเลนต์" หมายถึงพันธะเคมีที่อะตอมทั้งสองใช้อิเล็กตรอนร่วมกัน ซึ่งเรียกว่าการครอบครองร่วมกัน ดังนั้น มันจึงแตกต่าง เช่น จากโลหะซึ่งมีอิเล็กตรอนอิสระ หรือจากไอออนิกที่ตัวหนึ่งให้อิเล็กตรอนแก่อีกตัวหนึ่งโดยสมบูรณ์ ควรสังเกตว่ามันถูกสร้างขึ้นระหว่างอโลหะ
จากข้อมูลข้างต้น เราสามารถสรุปได้เล็กๆ น้อยๆ ว่ากระบวนการนี้เป็นอย่างไร มันเกิดขึ้นระหว่างอะตอมเนื่องจากการก่อตัวของคู่อิเล็กตรอนทั่วไป และคู่เหล่านี้เกิดขึ้นที่ระดับย่อยของอิเล็กตรอนภายนอกและก่อนภายนอก
ตัวอย่าง สารที่มีขั้ว:
ประเภทของพันธะโควาเลนต์
นอกจากนี้ยังมีสองประเภท: พันธะมีขั้วและตามนั้นคือพันธะไม่มีขั้ว เราจะวิเคราะห์คุณสมบัติของแต่ละรายการแยกกัน
การก่อตัวของขั้วโควาเลนต์
คำว่า "ขั้วโลก" หมายถึงอะไร?
 สิ่งที่มักจะเกิดขึ้นคืออะตอมสองอะตอมมีอิเล็กโตรเนกาติวีตี้ต่างกัน ดังนั้นอิเล็กตรอนที่พวกมันมีร่วมกันจึงไม่เท่ากัน แต่จะอยู่ใกล้กับอะตอมหนึ่งมากกว่าอีกอะตอมหนึ่งเสมอ ตัวอย่างเช่น โมเลกุลไฮโดรเจนคลอไรด์ ซึ่งอิเล็กตรอนของพันธะโควาเลนต์ตั้งอยู่ใกล้กับอะตอมของคลอรีน เนื่องจากอิเล็กโทรเนกาติวีตี้ของมันจะสูงกว่าไฮโดรเจน อย่างไรก็ตาม ในความเป็นจริง แรงดึงดูดของอิเล็กตรอนแตกต่างกันเล็กน้อยพอที่จะทำให้เกิดการถ่ายโอนอิเล็กตรอนโดยสมบูรณ์จากไฮโดรเจนไปยังคลอรีนได้
สิ่งที่มักจะเกิดขึ้นคืออะตอมสองอะตอมมีอิเล็กโตรเนกาติวีตี้ต่างกัน ดังนั้นอิเล็กตรอนที่พวกมันมีร่วมกันจึงไม่เท่ากัน แต่จะอยู่ใกล้กับอะตอมหนึ่งมากกว่าอีกอะตอมหนึ่งเสมอ ตัวอย่างเช่น โมเลกุลไฮโดรเจนคลอไรด์ ซึ่งอิเล็กตรอนของพันธะโควาเลนต์ตั้งอยู่ใกล้กับอะตอมของคลอรีน เนื่องจากอิเล็กโทรเนกาติวีตี้ของมันจะสูงกว่าไฮโดรเจน อย่างไรก็ตาม ในความเป็นจริง แรงดึงดูดของอิเล็กตรอนแตกต่างกันเล็กน้อยพอที่จะทำให้เกิดการถ่ายโอนอิเล็กตรอนโดยสมบูรณ์จากไฮโดรเจนไปยังคลอรีนได้
เป็นผลให้เมื่อมีขั้ว ความหนาแน่นของอิเล็กตรอนจะเปลี่ยนเป็นอิเลคโตรเนกาติตีที่มากกว่าและมีประจุลบบางส่วนปรากฏขึ้น ในทางกลับกัน นิวเคลียสซึ่งมีอิเลคโตรเนกาติวีตี้ต่ำกว่าจะพัฒนา จึงมีประจุบวกบางส่วนตามมา
เราสรุป:ขั้วเกิดขึ้นระหว่างอโลหะที่แตกต่างกันซึ่งมีค่าอิเล็กโตรเนกาติวีตี้ต่างกัน และอิเล็กตรอนจะตั้งอยู่ใกล้กับนิวเคลียสมากขึ้นโดยมีอิเล็กโตรเนกาติวีตี้มากกว่า
อิเล็กโทรเนกาติวีตี้คือความสามารถของอะตอมบางชนิดในการดึงดูดอิเล็กตรอนจากอะตอมอื่น ซึ่งทำให้เกิดปฏิกิริยาเคมี
ตัวอย่างของขั้วโควาเลนต์, สารที่มีพันธะโควาเลนต์มีขั้ว:
สูตรของสารที่มีพันธะโควาเลนต์มีขั้ว
โควาเลนต์ไม่มีขั้ว ความแตกต่างระหว่างขั้วและไม่มีขั้ว
และสุดท้าย ไม่ใช่ขั้ว เราจะได้รู้ว่ามันคืออะไร
ความแตกต่างที่สำคัญระหว่างไม่มีขั้วและขั้ว- นี่คือความสมมาตร หากในกรณีของพันธะขั้ว อิเล็กตรอนอยู่ใกล้อะตอมหนึ่งมากขึ้น ดังนั้นในพันธะที่ไม่มีขั้ว อิเล็กตรอนจะอยู่ในตำแหน่งสมมาตร นั่นคือ สัมพันธ์กับทั้งสองเท่าๆ กัน
เป็นที่น่าสังเกตว่าไม่มีขั้วเกิดขึ้นระหว่างอะตอมที่ไม่ใช่โลหะขององค์ประกอบทางเคมีชนิดเดียว
เช่น, สารที่มีพันธะโควาเลนต์ไม่มีขั้ว:
นอกจากนี้ กลุ่มของอิเล็กตรอนมักเรียกง่ายๆ ว่าเมฆอิเล็กตรอน โดยอาศัยเหตุนี้ เราจึงสรุปได้ว่ากลุ่มเมฆอิเล็กทรอนิกส์ในการสื่อสาร ซึ่งก่อตัวเป็นคู่อิเล็กตรอนทั่วไป มีการกระจายในอวกาศอย่างสมมาตร หรือสัมพันธ์กับนิวเคลียสของทั้งสองเท่าๆ กัน
ตัวอย่างของพันธะโควาเลนต์ไม่มีขั้วและรูปแบบการสร้างพันธะโควาเลนต์ไม่มีขั้ว

แต่ก็มีประโยชน์เช่นกันที่จะทราบวิธีแยกแยะระหว่างขั้วโควาเลนต์กับไม่มีขั้ว
โควาเลนต์ไม่มีขั้ว- สิ่งเหล่านี้ล้วนเป็นอะตอมของสารชนิดเดียวกันเสมอ H2. ซีแอล2.
บทความนี้สิ้นสุดลงแล้ว ตอนนี้เรารู้แล้วว่ากระบวนการทางเคมีนี้คืออะไร เรารู้วิธีให้คำจำกัดความและความหลากหลายของมัน เรารู้สูตรสำหรับการก่อตัวของสาร และโดยทั่วไปแล้ว อีกเล็กน้อยเกี่ยวกับโลกที่ซับซ้อนของเรา ประสบความสำเร็จใน เคมีและการเกิดสูตรใหม่
พันธะโควาเลนต์(จากภาษาละติน “co” รวมกันและ “vales” ที่มีแรง) เกิดขึ้นเนื่องจากคู่อิเล็กตรอนที่เป็นของทั้งสองอะตอม เกิดขึ้นระหว่างอะตอมที่ไม่ใช่โลหะ
อิเลคโตรเนกาติวีตี้ของอโลหะค่อนข้างสูงดังนั้นในระหว่างปฏิกิริยาทางเคมีของอะตอมอโลหะสองอะตอมการถ่ายโอนอิเล็กตรอนจากที่หนึ่งไปยังอีกที่หนึ่ง (เช่นในกรณี) จึงเป็นไปไม่ได้ ในกรณีนี้ จำเป็นต้องมีการรวมกลุ่มอิเล็กตรอนให้เสร็จสิ้น
ตัวอย่างเช่น เรามาพูดถึงอันตรกิริยาของอะตอมของไฮโดรเจนและคลอรีน:
H 1s 1 - หนึ่งอิเล็กตรอน
คลาส 1s 2 2s 2 2 หน้า 6 3 ส 2 3 หน้า 5 - เจ็ดอิเล็กตรอนในระดับภายนอก
อะตอมทั้งสองแต่ละอะตอมขาดอิเล็กตรอนหนึ่งตัวเพื่อให้มีเปลือกอิเล็กตรอนที่สมบูรณ์ และแต่ละอะตอมจะจัดสรรอิเล็กตรอนหนึ่งตัว “เพื่อการใช้งานทั่วไป” ดังนั้นกฎออคเต็ตจึงเป็นที่พอใจ สิ่งนี้แสดงได้ดีที่สุดโดยใช้สูตรลูอิส:
การก่อตัวของพันธะโควาเลนต์
อิเล็กตรอนที่ใช้ร่วมกันตอนนี้เป็นของทั้งสองอะตอม อะตอมไฮโดรเจนมีอิเล็กตรอนสองตัว (ของมันเองและอิเล็กตรอนที่ใช้ร่วมกันของอะตอมคลอรีน) และอะตอมของคลอรีนมีอิเล็กตรอนแปดตัว (ของมันเองบวกกับอิเล็กตรอนที่ใช้ร่วมกันของอะตอมไฮโดรเจน) อิเล็กตรอนที่ใช้ร่วมกันทั้งสองนี้ก่อให้เกิดพันธะโควาเลนต์ระหว่างอะตอมไฮโดรเจนและคลอรีน อนุภาคที่เกิดจากพันธะของอะตอมทั้งสองเรียกว่า โมเลกุล
พันธะโควาเลนต์ไม่มีขั้ว
พันธะโควาเลนต์ยังสามารถเกิดขึ้นได้ระหว่างสองพันธะ เหมือนกันอะตอม ตัวอย่างเช่น:

แผนภาพนี้อธิบายว่าทำไมไฮโดรเจนและคลอรีนจึงมีอยู่ในโมเลกุลไดอะตอมมิก ด้วยการจับคู่และแบ่งปันอิเล็กตรอนสองตัว ทำให้กฎออคเต็ตของอะตอมทั้งสองบรรลุผลได้
นอกจากพันธะเดี่ยวแล้ว ยังสามารถสร้างพันธะโควาเลนต์คู่หรือสามได้ เช่น ในโมเลกุลของออกซิเจน O 2 หรือไนโตรเจน N 2 อะตอมของไนโตรเจนมีเวเลนซ์อิเล็กตรอน 5 ตัว ดังนั้นจึงจำเป็นต้องมีอิเล็กตรอนอีก 3 ตัวเพื่อทำให้เปลือกสมบูรณ์ ซึ่งสามารถทำได้โดยการแบ่งปันอิเล็กตรอนสามคู่ ดังที่แสดงด้านล่าง:

สารประกอบโควาเลนต์มักเป็นก๊าซ ของเหลว หรือของแข็งที่ละลายได้ค่อนข้างต่ำ ข้อยกเว้นที่หาได้ยากประการหนึ่งคือเพชร ซึ่งละลายได้สูงกว่า 3,500 °C สิ่งนี้อธิบายได้ด้วยโครงสร้างของเพชร ซึ่งเป็นโครงตาข่ายต่อเนื่องกันของอะตอมคาร์บอนที่มีพันธะโควาเลนต์ ไม่ใช่การรวมตัวกันของโมเลกุลเดี่ยวๆ ในความเป็นจริงแล้ว คริสตัลเพชรใดๆ ก็ตาม ไม่ว่าจะมีขนาดเท่าใดก็ตาม ถือเป็นโมเลกุลขนาดใหญ่เพียงโมเลกุลเดียว
พันธะโควาเลนต์เกิดขึ้นเมื่ออิเล็กตรอนของอะตอมอโลหะสองอะตอมรวมกัน โครงสร้างผลลัพธ์เรียกว่าโมเลกุล
พันธะโควาเลนต์มีขั้ว
ในกรณีส่วนใหญ่จะมีอะตอมที่มีพันธะโควาเลนต์สองอะตอม แตกต่างอิเลคโตรเนกาติวีตี้และอิเล็กตรอนที่ใช้ร่วมกันไม่ได้เป็นของสองอะตอมเท่ากัน โดยส่วนใหญ่แล้วจะอยู่ใกล้กับอะตอมหนึ่งมากกว่าอีกอะตอมหนึ่ง ตัวอย่างเช่น ในโมเลกุลไฮโดรเจนคลอไรด์ อิเล็กตรอนที่ก่อพันธะโควาเลนต์จะตั้งอยู่ใกล้กับอะตอมของคลอรีนมากขึ้น เนื่องจากอิเล็กโทรเนกาติวีตี้ของมันจะสูงกว่าไฮโดรเจน อย่างไรก็ตามความแตกต่างในความสามารถในการดึงดูดอิเล็กตรอนนั้นมีไม่มากพอที่จะทำให้เกิดการถ่ายโอนอิเล็กตรอนโดยสมบูรณ์จากอะตอมไฮโดรเจนไปยังอะตอมของคลอรีน ดังนั้นพันธะระหว่างอะตอมของไฮโดรเจนและคลอรีนจึงถือได้ว่าเป็นลูกผสมระหว่างพันธะไอออนิก (การถ่ายโอนอิเล็กตรอนโดยสมบูรณ์) และพันธะโควาเลนต์ที่ไม่มีขั้ว (การจัดเรียงอิเล็กตรอนคู่ระหว่างสองอะตอมอย่างสมมาตร) ประจุบางส่วนของอะตอมแสดงด้วยอักษรกรีก δ การเชื่อมต่อนี้เรียกว่า โคเวเลนต์ขั้วโลก พันธะ และโมเลกุลของไฮโดรเจนคลอไรด์เรียกว่าเป็นขั้ว กล่าวคือ มีปลายที่มีประจุบวก (อะตอมไฮโดรเจน) และปลายที่มีประจุลบ (อะตอมของคลอรีน)

ตารางด้านล่างแสดงประเภทพันธะหลักและตัวอย่างของสาร:

กลไกการแลกเปลี่ยนและผู้รับบริจาคของการสร้างพันธะโควาเลนต์

1) กลไกการแลกเปลี่ยน แต่ละอะตอมก่อให้เกิดอิเล็กตรอนที่ไม่มีการจับคู่หนึ่งตัวกับคู่อิเล็กตรอนทั่วไป
2) กลไกของผู้บริจาค-ผู้รับ อะตอมหนึ่ง (ผู้บริจาค) ให้คู่อิเล็กตรอน และอีกอะตอมหนึ่ง (ตัวรับ) ให้วงโคจรว่างสำหรับคู่นั้น