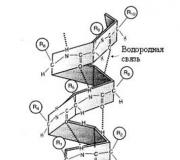
การเชื่อมต่อในโครงสร้างรองของโปรตีน โครงสร้างและหน้าที่ของโปรตีน ดูว่า "โครงสร้างรองของโปรตีน" ในพจนานุกรมอื่น ๆ คืออะไร
สำหรับโปรตีนทุกชนิด นอกเหนือจากโปรตีนหลักแล้ว ยังมีโปรตีนบางชนิดอีกด้วย โครงสร้างรอง. มักเป็นโมเลกุลโปรตีนมีลักษณะคล้ายสปริงที่ขยายออก
นี่คือสิ่งที่เรียกว่า a-helix ซึ่งมีความเสถียรโดยพันธะไฮโดรเจนจำนวนมากที่เกิดขึ้นระหว่างกลุ่ม CO และ NH ที่อยู่ใกล้เคียง อะตอมไฮโดรเจนของกลุ่ม NHกรดอะมิโนหนึ่งตัวก่อให้เกิดพันธะดังกล่าวกับอะตอมออกซิเจนของกลุ่ม CO ของกรดอะมิโนอีกตัวหนึ่ง ซึ่งแยกออกจากกรดอะมิโนตัวแรกด้วยเรซิดิวของกรดอะมิโนสี่ตัว
ดังนั้น กรดอะมิโน 1 ปรากฏว่าเชื่อมต่อกับกรดอะมิโน 5, กรดอะมิโน 2 กับกรดอะมิโน 6 เป็นต้น การวิเคราะห์โครงสร้างเอ็กซ์เรย์แสดงให้เห็นว่ามีกรดอะมิโนตกค้าง 3.6 ตัวต่อเทิร์นของเกลียว
โครงสร้างแบบขดลวดอย่างสมบูรณ์ดังนั้นเคราตินโปรตีนจึงมีโครงสร้างไฟบริลลาร์ มันเป็นโครงสร้าง โปรตีนผม ขนสัตว์ เล็บ จงอยปาก ขนนก และเขา ซึ่งเป็นส่วนหนึ่งของผิวหนังของสัตว์มีกระดูกสันหลังด้วย
ความแข็งและ ความสามารถในการยืดเคราตินแปรผันขึ้นอยู่กับจำนวนของตัวเชื่อมไดซัลไฟด์ระหว่างสายโพลีเปปไทด์ที่อยู่ติดกัน (ระดับของการเชื่อมโยงข้ามของสายโซ่)
ตามทฤษฎีแล้ว กลุ่ม CO และ NH ทั้งหมดสามารถมีส่วนร่วมในการก่อตัวได้ พันธะไฮโดรเจนดังนั้น α-helix จึงมีความเสถียรมากและจึงมีโครงสร้างที่ธรรมดามาก ส่วนของ α-helix ในโมเลกุลมีลักษณะคล้ายแท่งแข็ง อย่างไรก็ตาม โปรตีนส่วนใหญ่มีอยู่ในรูปแบบทรงกลม ซึ่งประกอบด้วยบริเวณต่างๆ (3 ชั้น (ดูด้านล่าง) และบริเวณที่มีโครงสร้างไม่สม่ำเสมอ
นี่คือคำอธิบายโดยข้อเท็จจริงที่ว่าการศึกษา พันธะไฮโดรเจนมีหลายปัจจัยที่ขัดขวางสิ่งนี้: การมีอยู่ของกรดอะมิโนบางชนิดที่ตกค้างในสายโซ่โพลีเปปไทด์ การมีอยู่ของสะพานไดซัลไฟด์ระหว่างส่วนต่าง ๆ ของสายโซ่เดียวกัน และสุดท้าย ความจริงที่ว่าโดยทั่วไปแล้วกรดอะมิโนโพรลีนไม่สามารถสร้างพันธะไฮโดรเจนได้ .
เบต้าเลเยอร์หรือ ชั้นพับเป็นโครงสร้างรองอีกประเภทหนึ่ง โปรตีนไหมไฟโบรอินซึ่งหลั่งออกมาจากต่อมดักจับไหมของหนอนไหมเมื่อทำการดัดรังไหม จะแสดงออกมาในรูปแบบนี้ทั้งหมด ไฟโบรอินประกอบด้วยสายโซ่โพลีเปปไทด์จำนวนหนึ่งที่มีความยาวมากกว่าสายโซ่ที่มีโครงสร้างอัลฟ่า เกลียว.
โซ่เหล่านี้วางขนานกัน แต่โซ่ที่อยู่ติดกันนั้นมีทิศทางตรงกันข้ามกัน (ตรงกันข้าม) พวกเขาเชื่อมต่อถึงกันโดยใช้ พันธะไฮโดรเจนเกิดขึ้นระหว่างกลุ่ม C=0- และ NH ของสายโซ่ข้างเคียง ในกรณีนี้ กลุ่ม NH และ C=0 ทั้งหมดก็มีส่วนร่วมในการก่อตัวของพันธะไฮโดรเจน กล่าวคือ โครงสร้างก็มีความเสถียรมากเช่นกัน
โครงสร้างของสายโซ่โพลีเปปไทด์นี้เรียกว่า โครงสร้างเบต้าและโครงสร้างโดยรวมเป็นชั้นพับ มีความต้านทานแรงดึงสูงและไม่สามารถยืดได้ แต่การเรียงตัวของสายโซ่โพลีเปปไทด์ทำให้ไหมมีความยืดหยุ่นสูง ในโปรตีนทรงกลมโซ่โพลีเปปไทด์สามารถพับตัวเองได้จากนั้นที่จุดเหล่านี้ของบริเวณทรงกลมจะปรากฏขึ้นซึ่งมีโครงสร้างของชั้นพับ
อื่น วิธีการจัดระเบียบสายโซ่โพลีเปปไทด์เราพบในคอลลาเจนโปรตีนไฟบริลลาร์ นี่เป็นโปรตีนโครงสร้างที่มีความต้านทานแรงดึงสูงเช่นเดียวกับเคราตินและไฟโบรอิน คอลลาเจนมีสายโพลีเปปไทด์สามสายที่บิดเข้าด้วยกันเหมือนเกลียวเชือกที่ก่อตัวเป็นเกลียวสามชั้น สายโพลีเปปไทด์แต่ละสายของเกลียวที่ซับซ้อนนี้เรียกว่าโทรโปคอลลาเจน มีกรดอะมิโนตกค้างประมาณ 1,000 ตัว สายโพลีเปปไทด์แต่ละสายเป็นอิสระ เกลียวขด(แต่ไม่ใช่ a-helix;)
โซ่สามเส้นถูกยึดไว้ด้วยกัน พันธะไฮโดรเจน. ไฟบริลเกิดขึ้นจากเกลียวสามอันเรียงตัวขนานกันและยึดติดกันด้วยพันธะโควาเลนต์ระหว่างสายโซ่ที่อยู่ติดกัน พวกมันก็จะรวมกันเป็นเส้นใย โครงสร้างของคอลลาเจนจึงเกิดขึ้นเป็นขั้นๆ หลายระดับ คล้ายกับโครงสร้างของเซลลูโลส คอลลาเจนไม่สามารถยืดออกได้ และคุณสมบัตินี้จำเป็นต่อการทำงานของคอลลาเจน เช่น ในเส้นเอ็น กระดูก และเนื้อเยื่อเกี่ยวพันประเภทอื่นๆ
กระรอกซึ่งมีอยู่เฉพาะในรูปแบบขดเต็มที่ เช่น เคราตินและคอลลาเจน ถือเป็นข้อยกเว้นในบรรดาโปรตีนอื่นๆ
โปรตีนเป็นองค์ประกอบอินทรีย์ที่สำคัญอย่างหนึ่งของเซลล์ที่มีชีวิตในร่างกาย พวกมันทำหน้าที่หลายอย่าง: รองรับ, การส่งสัญญาณ, เอนไซม์, การขนส่ง, โครงสร้าง, ตัวรับ ฯลฯ โครงสร้างโปรตีนระดับปฐมภูมิ ทุติยภูมิ ตติยภูมิ และควอเทอร์นารี ได้กลายเป็นการปรับตัวเชิงวิวัฒนาการที่สำคัญ โมเลกุลเหล่านี้ทำมาจากอะไร? เหตุใดโครงสร้างโปรตีนในเซลล์ของร่างกายที่ถูกต้องจึงมีความสำคัญ?
ส่วนประกอบโครงสร้างของโปรตีน
โมโนเมอร์ของสายโพลีเปปไทด์ใดๆ คือกรดอะมิโน (AA) สารประกอบอินทรีย์โมเลกุลต่ำเหล่านี้ค่อนข้างพบได้ทั่วไปในธรรมชาติและสามารถดำรงอยู่ได้ในฐานะโมเลกุลอิสระที่ทำหน้าที่โดยธรรมชาติ ซึ่งรวมถึงการขนส่งสาร การรับ การยับยั้งหรือการกระตุ้นของเอนไซม์
มีกรดอะมิโนชีวภาพประมาณ 200 ชนิด แต่พบได้เพียง 20 ชนิดเท่านั้น ละลายในน้ำได้ง่าย มีโครงสร้างเป็นผลึก และหลายชนิดมีรสหวาน
จากมุมมองทางเคมี AA คือโมเลกุลที่จำเป็นต้องมีกลุ่มฟังก์ชันสองกลุ่ม: -COOH และ -NH2 ด้วยความช่วยเหลือของกลุ่มเหล่านี้ กรดอะมิโนจะก่อตัวเป็นสายโซ่ซึ่งเชื่อมต่อกันด้วยพันธะเปปไทด์
กรดอะมิโนโปรตีโอนิกทั้ง 20 ชนิดมีอนุมูลอิสระ ขึ้นอยู่กับคุณสมบัติทางเคมีที่แตกต่างกันไป จากองค์ประกอบของอนุมูลดังกล่าว AA ทั้งหมดจะถูกจำแนกออกเป็นหลายกลุ่ม
- ไม่มีขั้ว: ไอโซลิวซีน, ไกลซีน, ลิวซีน, วาลีน, โพรลีน, อะลานีน
- มีขั้วและไม่มีประจุ: ธรีโอนีน, เมไทโอนีน, ซีสเตอีน, ซีรีน, กลูตามีน, แอสพาราจีน
- อะโรมาติก: ไทโรซีน, ฟีนิลอะลานีน, ทริปโตเฟน
- ขั้วและมีประจุลบ: กลูตาเมต, แอสปาร์เตต
- มีขั้วและมีประจุบวก: อาร์จินีน, ฮิสทิดีน, ไลซีน
ทุกระดับของการจัดระเบียบโครงสร้างโปรตีน (ปฐมภูมิ ทุติยภูมิ ตติยภูมิ ควอเทอร์นารี) ขึ้นอยู่กับสายโซ่โพลีเปปไทด์ที่ประกอบด้วย AK ข้อแตกต่างเพียงอย่างเดียวคือลำดับนี้จะพับในอวกาศได้อย่างไร และด้วยความช่วยเหลือจากพันธะเคมีชนิดใด โครงสร้างนี้จึงยังคงอยู่

โครงสร้างโปรตีนปฐมภูมิ
โปรตีนใด ๆ เกิดขึ้นบนไรโบโซม - ออร์แกเนลล์เซลล์ที่ไม่ใช่เมมเบรนซึ่งมีส่วนร่วมในการสังเคราะห์สายโซ่โพลีเปปไทด์ ที่นี่กรดอะมิโนเชื่อมต่อถึงกันโดยใช้พันธะเปปไทด์ที่แข็งแกร่งทำให้เกิดโครงสร้างหลัก อย่างไรก็ตาม โครงสร้างหลักของโปรตีนนี้แตกต่างอย่างมากจากโครงสร้างควอเทอร์นารี ดังนั้นจึงจำเป็นต้องมีการสุกแก่ของโมเลกุลเพิ่มเติม
โปรตีนเช่นอีลาสตินฮิสโตนกลูตาไธโอนแม้จะมีโครงสร้างที่เรียบง่ายก็สามารถทำหน้าที่ในร่างกายได้ สำหรับโปรตีนส่วนใหญ่ ขั้นต่อไปคือการก่อตัวของโครงสร้างรองที่ซับซ้อนมากขึ้น

โครงสร้างทุติยภูมิของโปรตีน
การก่อตัวของพันธะเปปไทด์เป็นขั้นตอนแรกในการทำให้โปรตีนส่วนใหญ่เจริญเติบโต เพื่อให้พวกเขาปฏิบัติหน้าที่ได้ โครงสร้างท้องถิ่นของพวกเขาจะต้องได้รับการเปลี่ยนแปลงบางอย่าง. สิ่งนี้สามารถทำได้ด้วยความช่วยเหลือของพันธะไฮโดรเจน - เปราะบาง แต่ในขณะเดียวกันก็มีการเชื่อมต่อมากมายระหว่างศูนย์กลางพื้นฐานและเป็นกรดของโมเลกุลกรดอะมิโน
นี่คือลักษณะการสร้างโครงสร้างรองของโปรตีน ซึ่งแตกต่างจากโครงสร้างควอเทอร์นารีในเรื่องความเรียบง่ายในการประกอบและโครงสร้างในท้องถิ่น อย่างหลังหมายความว่าไม่ใช่ทั้งโซ่ที่ผ่านการเปลี่ยนแปลง พันธะไฮโดรเจนสามารถก่อตัวได้ในหลายจุดโดยมีระยะห่างจากกัน และรูปแบบของพันธะยังขึ้นอยู่กับประเภทของกรดอะมิโนและวิธีการประกอบด้วย
ไลโซไซม์และเปปซินเป็นตัวแทนของโปรตีนที่มีโครงสร้างรอง เปปซินเกี่ยวข้องกับกระบวนการย่อยอาหารและไลโซไซม์ทำหน้าที่ป้องกันในร่างกายโดยทำลายผนังเซลล์ของแบคทีเรีย

คุณสมบัติของโครงสร้างรอง
โครงสร้างเฉพาะของสายเปปไทด์อาจแตกต่างกัน มีการศึกษาหลายสิบเรื่องแล้วและสามเรื่องเป็นเรื่องธรรมดาที่สุด ซึ่งรวมถึงอัลฟาเฮลิกส์ แผ่นเบต้า และเทิร์นเบต้า
- อัลฟาเกลียวเป็นหนึ่งในโครงสร้างรองทั่วไปของโปรตีนส่วนใหญ่ เป็นโครงเหล็กแข็งที่มีระยะชัก 0.54 นาโนเมตร อนุมูลของกรดอะมิโนจะถูกส่งออกไปด้านนอก
เอนริเก้ที่ถนัดขวานั้นพบได้บ่อยที่สุด และบางครั้งก็สามารถพบเอนริเก้ที่ถนัดซ้ายได้ ฟังก์ชั่นการสร้างรูปร่างนั้นดำเนินการโดยพันธะไฮโดรเจนซึ่งทำให้ลอนผมมั่นคง สายโซ่ที่ก่อตัวเป็นเกลียวอัลฟ่าประกอบด้วยกรดอะมิโนที่มีประจุโพรลีนและมีประจุขั้วน้อยมาก
- เทิร์นเบต้าถูกแยกออกเป็นโครงสร้างที่แยกจากกัน แม้ว่าจะเรียกได้ว่าเป็นส่วนหนึ่งของแผ่นเบต้าก็ตาม สาระสำคัญคือการโค้งงอของสายเปปไทด์ซึ่งได้รับการสนับสนุนโดยพันธะไฮโดรเจน โดยปกติแล้วส่วนโค้งนั้นประกอบด้วยกรดอะมิโน 4-5 ตัวซึ่งจำเป็นต้องมีโพรลีนด้วย AK นี้เป็นปืนเดียวที่มีโครงกระดูกที่แข็งและสั้น ซึ่งทำให้สามารถเลี้ยวได้
- ชั้นเบต้าคือสายโซ่ของกรดอะมิโนที่โค้งงอหลายส่วนและทำให้เสถียรด้วยพันธะไฮโดรเจน โครงสร้างนี้ชวนให้นึกถึงแผ่นกระดาษที่พับเป็นหีบเพลงมาก โปรตีนเชิงรุกส่วนใหญ่มักมีรูปแบบนี้ แต่มีข้อยกเว้นหลายประการ
มีชั้นเบต้าขนานและต้านขนาน ในกรณีแรก C- และ N-termini ที่จุดโค้งงอและที่ปลายโซ่จะตรงกัน แต่ในกรณีที่สองไม่ตรงกัน
โครงสร้างระดับอุดมศึกษา
การบรรจุโปรตีนเพิ่มเติมจะนำไปสู่การก่อตัวของโครงสร้างระดับตติยภูมิ โครงสร้างนี้ได้รับความเสถียรด้วยความช่วยเหลือของพันธะไฮโดรเจน ไดซัลไฟด์ ไม่ชอบน้ำ และไอออนิก จำนวนมากทำให้สามารถบิดโครงสร้างรองให้เป็นรูปร่างที่ซับซ้อนยิ่งขึ้นและทำให้เสถียรได้
แบ่งออกเป็นทรงกลมและโมเลกุลเปปไทด์ทรงกลมมีโครงสร้างเป็นทรงกลม ตัวอย่าง: อัลบูมิน, โกลบูลิน, ฮิสโตนในโครงสร้างตติยภูมิ
พวกมันสร้างเส้นที่แข็งแรงซึ่งมีความยาวเกินความกว้าง โปรตีนดังกล่าวส่วนใหญ่มักทำหน้าที่เกี่ยวกับโครงสร้างและการขึ้นรูปรูปร่าง ตัวอย่าง ได้แก่ ไฟโบรอิน เคราติน คอลลาเจน อีลาสติน

โครงสร้างของโปรตีนในโครงสร้างควอเทอร์นารีของโมเลกุล
หากหลายทรงกลมรวมกันเป็นหนึ่งเดียวจะเกิดโครงสร้างที่เรียกว่าควอเทอร์นารี โครงสร้างนี้ไม่ได้เป็นเรื่องปกติสำหรับเปปไทด์ทั้งหมด และจะเกิดขึ้นเมื่อจำเป็นต้องทำหน้าที่ที่สำคัญและเฉพาะเจาะจง
แต่ละทรงกลมในองค์ประกอบแสดงถึงโดเมนหรือโปรโตเมอร์ที่แยกจากกัน เรียกรวมกันว่าโมเลกุลนี้เรียกว่าโอลิโกเมอร์
โดยทั่วไปแล้ว โปรตีนดังกล่าวจะมีโครงสร้างที่เสถียรหลายประการ ซึ่งจะเข้ามาแทนที่กันอย่างต่อเนื่อง ขึ้นอยู่กับอิทธิพลของปัจจัยภายนอก หรือเมื่อจำเป็นในการทำหน้าที่ที่แตกต่างกัน
ความแตกต่างที่สำคัญระหว่างโครงสร้างตติยภูมิของโปรตีนและควอเทอร์นารีคือพันธะระหว่างโมเลกุลซึ่งมีหน้าที่ในการเชื่อมต่อหลายกลม ในใจกลางของโมเลกุลทั้งหมดมักจะมีไอออนของโลหะซึ่งส่งผลโดยตรงต่อการก่อตัวของพันธะระหว่างโมเลกุล
โครงสร้างโปรตีนเพิ่มเติม
สายกรดอะมิโนไม่เพียงพอต่อการทำหน้าที่ของโปรตีนเสมอไป ในกรณีส่วนใหญ่ สารอื่นๆ ที่มีลักษณะเป็นอินทรีย์และอนินทรีย์จะเกาะติดกับโมเลกุลดังกล่าว เนื่องจากคุณลักษณะนี้เป็นลักษณะของเอนไซม์ส่วนใหญ่ องค์ประกอบของโปรตีนเชิงซ้อนจึงมักถูกแบ่งออกเป็นสามส่วน:
- อะโปเอ็นไซม์เป็นส่วนโปรตีนของโมเลกุลซึ่งเป็นลำดับกรดอะมิโน
- โคเอ็นไซม์ไม่ใช่โปรตีน แต่เป็นส่วนอินทรีย์ อาจมีไขมัน คาร์โบไฮเดรต หรือแม้แต่กรดนิวคลีอิกหลายประเภท นอกจากนี้ยังรวมถึงตัวแทนของสารประกอบออกฤทธิ์ทางชีวภาพซึ่งรวมถึงวิตามินด้วย
- โคแฟกเตอร์เป็นชิ้นส่วนอนินทรีย์ ซึ่งในกรณีส่วนใหญ่แสดงด้วยไอออนของโลหะ
โครงสร้างของโปรตีนในโครงสร้างควอเทอร์นารีของโมเลกุลนั้นต้องอาศัยการมีส่วนร่วมของโมเลกุลหลายตัวที่มีต้นกำเนิดต่างกัน ดังนั้นเอนไซม์จำนวนมากจึงมีองค์ประกอบสามส่วนในคราวเดียว ตัวอย่างคือฟอสโฟไคเนส ซึ่งเป็นเอนไซม์ที่ช่วยให้แน่ใจว่ามีการถ่ายโอนกลุ่มฟอสเฟตจากโมเลกุล ATP
โครงสร้างควอเทอร์นารีของโมเลกุลโปรตีนเกิดขึ้นที่ไหน?
สายโซ่โพลีเปปไทด์เริ่มถูกสังเคราะห์บนไรโบโซมของเซลล์ แต่การเจริญของโปรตีนเพิ่มเติมเกิดขึ้นในออร์แกเนลล์อื่น โมเลกุลที่เกิดขึ้นใหม่จะต้องเข้าสู่ระบบการขนส่ง ซึ่งประกอบด้วยเมมเบรนนิวเคลียร์ ER อุปกรณ์ Golgi และไลโซโซม
ภาวะแทรกซ้อนของโครงสร้างเชิงพื้นที่ของโปรตีนเกิดขึ้นในร่างแหเอนโดพลาสมิกซึ่งไม่เพียงสร้างพันธะประเภทต่าง ๆ เท่านั้น (ไฮโดรเจน, ซัลไฟด์, ไม่ชอบน้ำ, โมเลกุลระหว่างโมเลกุล, ไอออนิก) แต่ยังเพิ่มโคเอ็นไซม์และโคแฟคเตอร์อีกด้วย นี่คือวิธีการสร้างโครงสร้างควอเทอร์นารีของโปรตีน
เมื่อโมเลกุลพร้อมสำหรับการทำงานอย่างสมบูรณ์ มันจะเข้าสู่ไซโตพลาสซึมของเซลล์หรืออุปกรณ์ Golgi ในกรณีหลัง เปปไทด์เหล่านี้จะถูกบรรจุลงในไลโซโซมและขนส่งไปยังช่องเซลล์อื่นๆ
ตัวอย่างของโปรตีนโอลิโกเมอร์
โครงสร้างควอเทอร์นารีเป็นโครงสร้างของโปรตีนที่ออกแบบมาเพื่ออำนวยความสะดวกในการทำงานที่สำคัญในสิ่งมีชีวิต โครงสร้างที่ซับซ้อนของโมเลกุลอินทรีย์ช่วยให้มีอิทธิพลต่อการทำงานของกระบวนการเมแทบอลิซึม (เอนไซม์) หลายอย่าง
โปรตีนที่มีความสำคัญทางชีวภาพ ได้แก่ เฮโมโกลบิน คลอโรฟิลล์ และฮีโมไซยานิน วงแหวนพอร์ไฟรินเป็นพื้นฐานของโมเลกุลเหล่านี้ โดยมีไอออนของโลหะอยู่ตรงกลาง
เฮโมโกลบิน
โครงสร้างควอเทอร์นารีของโมเลกุลโปรตีนฮีโมโกลบินประกอบด้วย 4 โกลบูลที่เชื่อมต่อกันด้วยพันธะระหว่างโมเลกุล ตรงกลางมีพอร์ฟีนพร้อมไอออนของเหล็ก โปรตีนถูกขนส่งไปในไซโตพลาสซึมของเซลล์เม็ดเลือดแดง โดยที่พวกมันครอบครองประมาณ 80% ของปริมาตรทั้งหมดของไซโตพลาสซึม
พื้นฐานของโมเลกุลคือฮีม ซึ่งเป็นสารอนินทรีย์ในธรรมชาติมากกว่าและมีสีแดง อีกทั้งยังเป็นการสลายฮีโมโกลบินในตับด้วย
เราทุกคนรู้ดีว่าฮีโมโกลบินทำหน้าที่ขนส่งที่สำคัญ นั่นคือการถ่ายเทออกซิเจนและคาร์บอนไดออกไซด์ไปทั่วร่างกายมนุษย์ โครงสร้างที่ซับซ้อนของโมเลกุลโปรตีนก่อให้เกิดศูนย์กลางที่มีฤทธิ์พิเศษซึ่งสามารถจับก๊าซที่เกี่ยวข้องกับฮีโมโกลบินได้
เมื่อคอมเพล็กซ์โปรตีน-แก๊สเกิดขึ้น จะเกิดสิ่งที่เรียกว่าออกซีฮีโมโกลบินและคาร์โบฮีโมโกลบิน อย่างไรก็ตาม มีความสัมพันธ์อีกประเภทหนึ่งที่ค่อนข้างคงที่: คาร์บอกซีฮีโมโกลบิน มันเป็นโปรตีนที่ซับซ้อนและคาร์บอนมอนอกไซด์ซึ่งมีความเสถียรซึ่งอธิบายการโจมตีของการหายใจไม่ออกเนื่องจากความเป็นพิษมากเกินไป

คลอโรฟิลล์
ตัวแทนของโปรตีนอีกชนิดหนึ่งที่มีโครงสร้างควอเทอร์นารีซึ่งมีแมกนีเซียมไอออนรองรับการเชื่อมต่อโดเมน หน้าที่หลักของโมเลกุลทั้งหมดคือการมีส่วนร่วมในกระบวนการสังเคราะห์แสงในพืช
คลอโรฟิลล์มีหลายประเภท ซึ่งแตกต่างกันตามอนุมูลของวงแหวนพอร์ไฟริน แต่ละพันธุ์เหล่านี้จะมีเครื่องหมายตัวอักษรละตินแยกกัน ตัวอย่างเช่น พืชบกมีลักษณะเป็นคลอโรฟิลล์ เอ หรือคลอโรฟิลล์ บี และโปรตีนประเภทอื่นๆ นี้จะพบได้ในสาหร่าย

เฮโมไซยานิน
โมเลกุลนี้เป็นอะนาล็อกของฮีโมโกลบินในสัตว์ชั้นล่างหลายชนิด (สัตว์ขาปล้อง หอยแมลงภู่ ฯลฯ) ความแตกต่างที่สำคัญระหว่างโครงสร้างโปรตีนและโครงสร้างควอเทอร์นารีของโมเลกุลคือการมีไอออนสังกะสีแทนที่จะเป็นไอออนเหล็ก เฮโมไซยานินมีสีฟ้า
บางครั้งผู้คนสงสัยว่าจะเกิดอะไรขึ้นถ้าเราเปลี่ยนฮีโมโกลบินของมนุษย์เป็นฮีโมไซยานิน ในกรณีนี้ปริมาณสารในเลือดตามปกติและโดยเฉพาะอย่างยิ่งกรดอะมิโนจะหยุดชะงัก นอกจากนี้เฮโมไซยานินยังสร้างสารเชิงซ้อนที่ไม่เสถียรกับคาร์บอนไดออกไซด์ ดังนั้นเลือดสีน้ำเงินจึงมีแนวโน้มที่จะเกิดลิ่มเลือด
§ 8. การจัดระเบียบเชิงพื้นที่ของโมเลกุลโปรตีน
โครงสร้างหลัก
โครงสร้างปฐมภูมิของโปรตีนเป็นที่เข้าใจกันว่าเป็นจำนวนและลำดับของการสลับกันของกรดอะมิโนที่ตกค้างซึ่งเชื่อมต่อถึงกันด้วยพันธะเปปไทด์ในสายโซ่โพลีเปปไทด์
สายโซ่โพลีเปปไทด์ที่ปลายด้านหนึ่งประกอบด้วยหมู่ NH 2 อิสระที่ไม่เกี่ยวข้องกับการก่อตัวของพันธะเปปไทด์ ส่วนนี้ถูกกำหนดให้เป็น เอ็น-ปลายทาง. ฝั่งตรงข้ามมีกลุ่ม NOOS อิสระซึ่งไม่เกี่ยวข้องกับการก่อตัวของพันธะเปปไทด์ นี่คือ - C-end. N-end ถือเป็นจุดเริ่มต้นของสายโซ่ และจากตรงนี้เองที่การนับจำนวนกรดอะมิโนตกค้างเริ่มต้นขึ้น:
ลำดับกรดอะมิโนของอินซูลินถูกกำหนดโดย F. Sanger (มหาวิทยาลัยเคมบริดจ์) โปรตีนนี้ประกอบด้วยสายโพลีเปปไทด์สองสาย สายหนึ่งประกอบด้วยกรดอะมิโน 21 ตัวที่เหลือ อีกสายหนึ่งมี 30 ตัว สายโซ่เชื่อมต่อกันด้วยสะพานไดซัลไฟด์ 2 ตัว (รูปที่ 6)
ข้าว. 6. โครงสร้างหลักของอินซูลินของมนุษย์
ใช้เวลา 10 ปีในการถอดรหัสโครงสร้างนี้ (พ.ศ. 2487 - 2497) ปัจจุบันมีการกำหนดโครงสร้างหลักสำหรับโปรตีนหลายชนิด กระบวนการในการพิจารณานั้นเป็นแบบอัตโนมัติและไม่ก่อให้เกิดปัญหาร้ายแรงสำหรับนักวิจัย
ข้อมูลเกี่ยวกับโครงสร้างปฐมภูมิของโปรตีนแต่ละชนิดจะถูกเข้ารหัสในยีน (ส่วนหนึ่งของโมเลกุล DNA) และเกิดขึ้นในระหว่างการถอดรหัส (การคัดลอกข้อมูลไปยัง mRNA) และการแปล (การสังเคราะห์สายโซ่โพลีเปปไทด์) ในเรื่องนี้ มีความเป็นไปได้ที่จะสร้างโครงสร้างหลักของโปรตีนจากโครงสร้างที่ทราบของยีนที่เกี่ยวข้องด้วย
ขึ้นอยู่กับโครงสร้างปฐมภูมิของโปรตีนที่คล้ายคลึงกัน เราสามารถตัดสินความสัมพันธ์ทางอนุกรมวิธานของสปีชีส์ได้ โปรตีนที่คล้ายคลึงกันคือโปรตีนที่ทำหน้าที่เหมือนกันในสายพันธุ์ต่างๆ โปรตีนดังกล่าวมีลำดับกรดอะมิโนที่คล้ายคลึงกัน ตัวอย่างเช่น โปรตีนไซโตโครม ซีในสปีชีส์ส่วนใหญ่มีน้ำหนักโมเลกุลสัมพัทธ์ประมาณ 12,500 และมีกรดอะมิโนตกค้างประมาณ 100 ตัว ความแตกต่างในโครงสร้างหลักของไซโตโครม C ระหว่างทั้งสองสายพันธุ์นั้นเป็นสัดส่วนกับความแตกต่างทางสายวิวัฒนาการระหว่างสายพันธุ์ที่กำหนด ดังนั้นไซโตโครม C ของม้าและยีสต์จึงต่างกันในกรดอะมิโน 48 ชนิด ไก่และเป็ด โดยแบ่งเป็น 2 ส่วน ในขณะที่ไซโตโครมของไก่และไก่งวงเหมือนกัน
โครงสร้างรอง
โครงสร้างรองของโปรตีนเกิดขึ้นเนื่องจากการก่อตัวของพันธะไฮโดรเจนระหว่างกลุ่มเปปไทด์ โครงสร้างรองมีสองประเภท: α-เกลียว และ β-โครงสร้าง (หรือชั้นพับ). โปรตีนยังอาจมีบริเวณของสายโซ่โพลีเปปไทด์ที่ไม่ก่อรูปโครงสร้างทุติยภูมิ
α-helix มีรูปร่างเหมือนสปริง เมื่อเกิดα-helix อะตอมออกซิเจนของแต่ละกลุ่มเปปไทด์จะสร้างพันธะไฮโดรเจนกับอะตอมไฮโดรเจนของกลุ่ม NH ที่สี่ตามสายโซ่:
การหมุนแต่ละครั้งของเกลียวจะเชื่อมต่อกับเกลียวถัดไปของเกลียวด้วยพันธะไฮโดรเจนหลายอันซึ่งทำให้โครงสร้างมีความแข็งแกร่งอย่างมีนัยสำคัญ α-helix มีลักษณะดังต่อไปนี้: เส้นผ่านศูนย์กลางของเกลียวคือ 0.5 นาโนเมตร, ระยะพิตช์ของเกลียวคือ 0.54 นาโนเมตร, มีกรดอะมิโนตกค้าง 3.6 ตัวต่อการหมุนของเกลียว (รูปที่ 7)
ข้าว. 7. แบบจำลองของ a-helix สะท้อนถึงคุณลักษณะเชิงปริมาณ
อนุมูลด้านข้างของกรดอะมิโนจะถูกส่งออกจากα-helix (รูปที่ 8)
ข้าว. 8. แบบจำลองของ -helix สะท้อนการจัดเรียงเชิงพื้นที่ของอนุมูลด้านข้าง
สามารถสร้างเอนริเก้ทั้งซ้ายและขวาได้จากกรด L-amino ตามธรรมชาติ โปรตีนธรรมชาติส่วนใหญ่มีลักษณะเป็นเกลียวที่ถนัดขวา เอนริเก้ทั้งซ้ายและขวาสามารถสร้างได้จากกรด D-amino สายโพลีเปปไทด์ซึ่งประกอบด้วยของผสมของเรซิดิวของกรด D- และ L-อะมิโน ไม่สามารถสร้างเกลียวได้
กรดอะมิโนบางชนิดที่ตกค้างป้องกันการก่อตัวของα-helix ตัวอย่างเช่น หากเรซิดิวของกรดอะมิโนที่มีประจุบวกหรือลบหลายตัวเรียงกันเป็นแถวในสายโซ่ บริเวณดังกล่าวจะไม่รับโครงสร้าง α-helical เนื่องจากการผลักกันของอนุมูลที่มีประจุเหมือนกัน การก่อตัวของ α-helices ถูกขัดขวางโดยอนุมูลของกรดอะมิโนขนาดใหญ่ที่ตกค้าง อุปสรรคต่อการก่อตัวของα-helix ก็คือการมีโพรลีนตกค้างในสายโซ่โพลีเปปไทด์ (รูปที่ 9) โพรลีนตกค้างที่อะตอมไนโตรเจนซึ่งสร้างพันธะเปปไทด์กับกรดอะมิโนอื่นไม่มีอะตอมไฮโดรเจน
ข้าว. 9. สารตกค้างของโพรลีนป้องกันการก่อตัวของเกลียว
ดังนั้นโพรลีนเรซิดิวที่เป็นส่วนหนึ่งของสายโซ่โพลีเปปไทด์จึงไม่สามารถสร้างพันธะไฮโดรเจนในสายโซ่ได้ นอกจากนี้ อะตอมไนโตรเจนในโพรลีนยังเป็นส่วนหนึ่งของวงแหวนแข็ง ซึ่งทำให้การหมุนรอบพันธะ N-C และการก่อตัวของเกลียวเป็นไปไม่ได้
นอกจาก α-helix แล้ว ยังมีการอธิบายเอนริเก้ประเภทอื่นๆ อีกด้วย อย่างไรก็ตาม พวกมันหายาก ส่วนใหญ่จะอยู่ในพื้นที่สั้นๆ
การก่อตัวของพันธะไฮโดรเจนระหว่างกลุ่มเปปไทด์ของชิ้นส่วนโพลีเปปไทด์ที่อยู่ใกล้เคียงทำให้เกิดการก่อตัว โครงสร้างβหรือชั้นพับ:
ต่างจาก α-helix ตรงที่ชั้นพับนั้นมีรูปร่างซิกแซก คล้ายกับหีบเพลง (รูปที่ 10)
ข้าว. 10. โครงสร้างβ-โปรตีน
มีชั้นพับขนานและต้านขนาน โครงสร้างขนานβเกิดขึ้นระหว่างส่วนของโซ่โพลีเปปไทด์ซึ่งมีทิศทางตรงกัน:
โครงสร้าง β ที่ต้านขนานนั้นเกิดขึ้นระหว่างส่วนที่ตรงข้ามกันของสายโซ่โพลีเปปไทด์:
โครงสร้าง β สามารถก่อตัวขึ้นระหว่างสายโพลีเปปไทด์มากกว่าสองสาย:
ในโปรตีนบางชนิด โครงสร้างทุติยภูมิสามารถแสดงได้ด้วย α-เกลียวเท่านั้น ในส่วนอื่นๆ - เฉพาะด้วยโครงสร้าง β เท่านั้น (ขนานหรือขนานกัน หรือทั้งสองอย่าง) ในโครงสร้างอื่นๆ พร้อมด้วยบริเวณ α-ขดลวด โครงสร้าง β อาจแสดงด้วย เป็นปัจจุบัน.
โครงสร้างระดับอุดมศึกษา
ในโปรตีนหลายชนิด โครงสร้างที่มีการจัดเรียงทุติยภูมิ (α-helices, -structures) จะถูกพับในลักษณะใดลักษณะหนึ่งให้เป็นทรงกลมที่มีขนาดกะทัดรัด การจัดระเบียบเชิงพื้นที่ของโปรตีนทรงกลมเรียกว่าโครงสร้างตติยภูมิ ดังนั้นโครงสร้างระดับตติยภูมิจึงเป็นลักษณะการจัดเรียงสามมิติของส่วนต่างๆ ของสายโซ่โพลีเปปไทด์ในอวกาศ พันธะไอออนิกและไฮโดรเจน ปฏิกิริยาที่ไม่ชอบน้ำ และแรงแวนเดอร์วาลส์มีส่วนร่วมในการก่อตัวของโครงสร้างตติยภูมิ สะพานไดซัลไฟด์ทำให้โครงสร้างตติยภูมิมั่นคง
โครงสร้างระดับตติยภูมิของโปรตีนถูกกำหนดโดยลำดับกรดอะมิโน ในระหว่างการก่อตัวของมัน พันธะสามารถเกิดขึ้นได้ระหว่างกรดอะมิโนที่อยู่ในระยะไกลมากในสายโซ่โพลีเปปไทด์ ในโปรตีนที่ละลายน้ำได้ตามกฎแล้วอนุมูลของกรดอะมิโนขั้วโลกจะปรากฏบนพื้นผิวของโมเลกุลโปรตีนและบ่อยครั้งที่อยู่ภายในโมเลกุล อนุมูลที่ไม่ชอบน้ำจะปรากฏอย่างแน่นหนาภายในทรงกลมทำให้เกิดบริเวณที่ไม่ชอบน้ำ
ปัจจุบันโครงสร้างระดับตติยภูมิของโปรตีนหลายชนิดได้ถูกสร้างขึ้นแล้ว ลองดูสองตัวอย่าง
ไมโอโกลบิน
ไมโอโกลบินเป็นโปรตีนที่จับกับออกซิเจนซึ่งมีมวลสัมพัทธ์ 16,700 หน้าที่ของมันคือกักเก็บออกซิเจนไว้ในกล้ามเนื้อ โมเลกุลประกอบด้วยสายโพลีเปปไทด์หนึ่งสายซึ่งประกอบด้วยกรดอะมิโน 153 ตัวและกลุ่มฮีโมกรุ๊ปซึ่งมีบทบาทสำคัญในการจับกับออกซิเจน
องค์กรเชิงพื้นที่ของ myoglobin ก่อตั้งขึ้นด้วยผลงานของ John Kendrew และเพื่อนร่วมงานของเขา (รูปที่ 11) โมเลกุลของโปรตีนนี้ประกอบด้วยบริเวณ α-helical 8 ส่วน ซึ่งคิดเป็น 80% ของกรดอะมิโนที่ตกค้างทั้งหมด โมเลกุลของไมโอโกลบินมีขนาดกะทัดรัดมาก โดยมีเพียงโมเลกุลของน้ำเพียง 4 โมเลกุลเท่านั้นที่สามารถใส่เข้าไปได้ อนุมูลของกรดอะมิโนขั้วโลกเกือบทั้งหมดจะอยู่ที่พื้นผิวด้านนอกของโมเลกุล อนุมูลที่ไม่ชอบน้ำส่วนใหญ่จะอยู่ภายในโมเลกุล และใกล้กับพื้นผิวจะมีฮีม ซึ่งเป็นกลุ่มที่ไม่ใช่โปรตีนที่ทำหน้าที่จับกับออกซิเจน
มะเดื่อ 11. โครงสร้างระดับตติยภูมิของไมโอโกลบิน
ไรโบนิวคลีเอส
Ribonuclease เป็นโปรตีนทรงกลม มันถูกหลั่งออกมาจากเซลล์ตับอ่อนซึ่งเป็นเอนไซม์ที่กระตุ้นการสลายของอาร์เอ็นเอ โมเลกุลของไรโบนิวคลีเอสต่างจากไมโอโกลบินตรงที่มีบริเวณ α-helical น้อยมากและมีส่วนที่อยู่ในโครงสร้าง β ค่อนข้างมาก ความแข็งแรงของโครงสร้างตติยภูมิของโปรตีนนั้นได้มาจากพันธะไดซัลไฟด์ 4 พันธะ
โครงสร้างควอเตอร์นารี
โปรตีนหลายชนิดประกอบด้วยหน่วยย่อยหรือโมเลกุลของโปรตีนหลายหน่วย สองหน่วยขึ้นไป ซึ่งมีโครงสร้างทุติยภูมิและตติยภูมิจำเพาะ จับยึดเข้าด้วยกันด้วยพันธะไฮโดรเจนและไอออนิก ปฏิกิริยาที่ไม่ชอบน้ำ และแรงแวนเดอร์วาลส์ การรวมตัวกันของโมเลกุลโปรตีนนี้เรียกว่า โครงสร้างควอเทอร์นารีและโปรตีนเองก็ถูกเรียกว่า โอลิโกเมอร์. หน่วยย่อยที่แยกจากกันหรือโมเลกุลโปรตีนภายในโปรตีนโอลิโกเมอร์เรียกว่า โปรโตเมอร์.
จำนวนโปรโตเมอร์ในโปรตีนโอลิโกเมอริกอาจแตกต่างกันอย่างมาก ตัวอย่างเช่น creatine kinase ประกอบด้วย 2 โปรโตเมอร์, เฮโมโกลบิน - ของ 4 โปรโตเมอร์, E. coli RNA polymerase - เอนไซม์ที่รับผิดชอบในการสังเคราะห์ RNA - ของ 5 โปรโตเมอร์, pyruvate dehydrogenase complex - ของ 72 โปรโตเมอร์ หากโปรตีนประกอบด้วยโปรโตเมอร์สองตัวจะเรียกว่าไดเมอร์สี่ - เตตระเมอร์หก - เฮกซาเมอร์ (รูปที่ 12) บ่อยครั้งที่โมเลกุลโปรตีนโอลิโกเมอริกประกอบด้วยโปรโตเมอร์ 2 หรือ 4 ตัว โปรตีนโอลิโกเมอร์อาจมีโปรโตเมอร์ที่เหมือนกันหรือต่างกัน หากโปรตีนมีโปรโตเมอร์ที่เหมือนกันสองตัว มันจะเป็น - โฮโมไดเมอร์ถ้าแตกต่าง - เฮเทอโรไดเมอร์.
ข้าว. 12. โปรตีนโอลิโกเมอร์
ให้เราพิจารณาการจัดโมเลกุลของฮีโมโกลบิน หน้าที่หลักของฮีโมโกลบินคือลำเลียงออกซิเจนจากปอดไปยังเนื้อเยื่อและคาร์บอนไดออกไซด์ไปในทิศทางตรงกันข้าม โมเลกุลของมัน (รูปที่ 13) ประกอบด้วยสายโซ่โพลีเปปไทด์สี่สายซึ่งมีสองประเภทที่แตกต่างกัน - สายโซ่α สองสายและสายโซ่ β สองสายและฮีม เฮโมโกลบินเป็นโปรตีนที่เกี่ยวข้องกับไมโอโกลบิน โครงสร้างทุติยภูมิและตติยภูมิของไมโอโกลบินและโปรโตเมอร์ฮีโมโกลบินมีความคล้ายคลึงกันมาก โปรโตเมอร์ของฮีโมโกลบินแต่ละตัวมีส่วน α-helical 8 ส่วนของสายโพลีเปปไทด์ เช่นเดียวกับไมโอโกลบิน ควรสังเกตว่าในโครงสร้างปฐมภูมิของไมโอโกลบินและโปรโตเมอร์ของฮีโมโกลบิน มีกรดอะมิโนตกค้างเพียง 24 ตัวเท่านั้นที่เหมือนกัน ด้วยเหตุนี้ โปรตีนที่มีโครงสร้างหลักแตกต่างกันอย่างมีนัยสำคัญอาจมีโครงสร้างเชิงพื้นที่คล้ายกันและทำหน้าที่คล้ายกัน
ข้าว. 13. โครงสร้างของฮีโมโกลบิน
โครงสร้างรองคือวิธีการจัดเรียงสายโซ่โพลีเปปไทด์ให้เป็นโครงสร้างที่ได้รับคำสั่ง โครงสร้างรองถูกกำหนดโดยโครงสร้างหลัก เนื่องจากโครงสร้างหลักถูกกำหนดโดยพันธุกรรม การก่อตัวของโครงสร้างรองจึงสามารถเกิดขึ้นได้เมื่อสายโซ่โพลีเปปไทด์ออกจากไรโบโซม โครงสร้างรองมีความเสถียร พันธะไฮโดรเจนซึ่งเกิดขึ้นระหว่างพันธะเปปไทด์ของกลุ่ม NH และ CO
แยกแยะ a-helix, โครงสร้าง bและโครงสร้างที่ไม่เป็นระเบียบ (เย้ายวน).
โครงสร้าง α-เอนริเก้ ถูกเสนอ พอลลิ่งและ คอเรย์(1951) นี่คือโครงสร้างรองโปรตีนชนิดหนึ่งที่มีลักษณะคล้ายเกลียวปกติ (รูปที่ 2.2) α-helix เป็นโครงสร้างรูปแท่งซึ่งมีพันธะเปปไทด์อยู่ภายในเกลียวและมีอนุมูลของกรดอะมิโนสายโซ่ด้านข้างอยู่ด้านนอก a-helix นั้นเสถียรด้วยพันธะไฮโดรเจนซึ่งขนานกับแกนเกลียวและเกิดขึ้นระหว่างกรดอะมิโนตัวแรกและตัวที่ห้าที่ตกค้าง ดังนั้นในบริเวณที่เป็นเกลียวขยายออกไป กรดอะมิโนแต่ละตัวจะมีส่วนร่วมในการก่อตัวของพันธะไฮโดรเจนสองตัว
ข้าว. 2.2. โครงสร้างของ α-helix
มีกรดอะมิโนตกค้าง 3.6 นาโนเมตรต่อรอบของเกลียว ระยะพิทช์เกลียวคือ 0.54 นาโนเมตร และมี 0.15 นาโนเมตรต่อกรดอะมิโนตกค้าง มุมเกลียวคือ 26° ระยะเวลาสม่ำเสมอของ a-helix คือ 5 รอบหรือ 18 กรดอะมิโนตกค้าง ที่พบมากที่สุดคือ a-helices ที่ถนัดขวาเช่น เกลียวหมุนตามเข็มนาฬิกา การก่อตัวของ a-helix ถูกป้องกันโดยโพรลีน, กรดอะมิโนที่มีอนุมูลที่มีประจุและขนาดใหญ่ (สิ่งกีดขวางทางไฟฟ้าสถิตและทางกล)
มีรูปทรงเกลียวอีกอันหนึ่งอยู่ คอลลาเจน . ในร่างกายของสัตว์เลี้ยงลูกด้วยนม คอลลาเจนเป็นโปรตีนที่มีความสำคัญในเชิงปริมาณ โดยคิดเป็น 25% ของโปรตีนทั้งหมด คอลลาเจนมีอยู่ในรูปแบบต่างๆ โดยเฉพาะในเนื้อเยื่อเกี่ยวพัน เป็นเกลียวซ้ายที่มีระยะพิทช์ 0.96 นาโนเมตรและมีเรซิดิว 3.3 ต่อเทิร์น ซึ่งแบนกว่าเกลียว α การก่อตัวของสะพานไฮโดรเจนไม่เหมือนกับ α-helix ที่นี่ คอลลาเจนมีองค์ประกอบของกรดอะมิโนที่ผิดปกติ: 1/3 คือไกลซีน โพรลีนประมาณ 10% รวมถึงไฮดรอกซีโพรลีนและไฮดรอกซีไลซีน กรดอะมิโนสองตัวสุดท้ายเกิดขึ้นหลังจากการสังเคราะห์คอลลาเจนโดยการดัดแปลงหลังการแปล ในโครงสร้างของคอลลาเจนนั้น gly-X-Y triplet จะถูกทำซ้ำอย่างต่อเนื่อง โดยตำแหน่ง X มักถูกครอบครองโดยโพรลีน และตำแหน่ง Y คือไฮดรอกซีไลซีน มีหลักฐานที่ดีว่าคอลลาเจนปรากฏอยู่ทุกหนทุกแห่งในรูปของเกลียวสามเกลียวสำหรับมือขวาที่บิดจากเกลียวหลักสำหรับมือซ้ายสามเกลียว ในเกลียวสาม สารตกค้างทุกๆ สามจะจบลงที่จุดศูนย์กลาง โดยที่เฉพาะไกลซีนเท่านั้นที่เหมาะกับเหตุผลด้านสเตอริก โมเลกุลคอลลาเจนทั้งหมดมีความยาวประมาณ 300 นาโนเมตร
b-โครงสร้าง(ชั้นพับ b) พบได้ในโปรตีนทรงกลมและในโปรตีนไฟบริลลาร์บางชนิด เช่น ซิลค์ไฟโบรอิน (รูปที่ 2.3)

ข้าว. 2.3. b-โครงสร้าง
โครงสร้างก็มี รูปร่างแบน. สายโซ่โพลีเปปไทด์นั้นยาวเกือบหมดแทนที่จะบิดแน่นเหมือนในเกลียวเอ ระนาบของพันธะเปปไทด์ตั้งอยู่ในอวกาศเหมือนกับการพับกระดาษสม่ำเสมอกัน มันถูกทำให้เสถียรโดยพันธะไฮโดรเจนระหว่างกลุ่ม CO และ NH ของพันธะเปปไทด์ของโซ่โพลีเปปไทด์ที่อยู่ติดกัน ถ้าสายโพลีเปปไทด์ที่สร้างโครงสร้าง b ไปในทิศทางเดียวกัน (นั่นคือ ปลาย C และ N ตรงกัน) – โครงสร้าง b แบบขนาน; ถ้าตรงกันข้าม - โครงสร้าง b ขนานกัน. อนุมูลด้านข้างของชั้นหนึ่งจะถูกวางไว้ระหว่างอนุมูลด้านข้างของอีกชั้นหนึ่ง ถ้าสายโพลีเปปไทด์เส้นหนึ่งโค้งงอและวิ่งขนานกับตัวมันเอง ก็จะเป็นเช่นนี้ โครงสร้าง b-cross ขนานกัน. พันธะไฮโดรเจนในโครงสร้าง b-cross เกิดขึ้นระหว่างกลุ่มเปปไทด์ของลูปของสายโซ่โพลีเปปไทด์
เนื้อหาของเอ-เอนริเก้ในโปรตีนที่ศึกษาจนถึงปัจจุบันมีความแปรปรวนอย่างมาก ในโปรตีนบางชนิดเช่น myoglobin และ hemoglobin a-helix รองรับโครงสร้างและคิดเป็น 75% ในไลโซไซม์ - 42% ในเปปซินเพียง 30% ตัวอย่างเช่น โปรตีนอื่นๆ เช่น เอนไซม์ย่อยอาหารไคโมทริปซิน ในทางปฏิบัติแล้วไม่มีโครงสร้างแบบ a-helical และส่วนสำคัญของสายโซ่โพลีเปปไทด์ที่พอดีกับโครงสร้าง b แบบชั้นๆ สนับสนุนเนื้อเยื่อโปรตีนคอลลาเจน (โปรตีนจากเส้นเอ็นและผิวหนัง), ไฟโบรอิน (โปรตีนไหมธรรมชาติ) มีโครงแบบ b ของสายโซ่โพลีเปปไทด์
ได้รับการพิสูจน์แล้วว่าการก่อตัวของ α-helices ได้รับการอำนวยความสะดวกโดยโครงสร้าง glu, ala, leu และ β โดย met, val, ile; ในจุดที่สายโซ่โพลีเปปไทด์โค้งงอ - gly, pro, asn เชื่อกันว่าสารตกค้างที่กระจุกกัน 6 ชนิด ซึ่ง 4 ชนิดมีส่วนทำให้เกิดการก่อตัวของเกลียว ถือได้ว่าเป็นศูนย์กลางของการทำให้เป็นเกลียว จากศูนย์กลางนี้มีการเติบโตของเอนริเก้ทั้งสองทิศทางไปยังส่วน - เตตราเปปไทด์ซึ่งประกอบด้วยสารตกค้างที่ป้องกันการก่อตัวของเอนริเก้เหล่านี้ ในระหว่างการก่อตัวของโครงสร้าง β บทบาทของไพรเมอร์จะเกิดขึ้นโดยสามในห้าของกรดอะมิโนที่ตกค้างซึ่งมีส่วนทำให้เกิดการก่อตัวของโครงสร้าง β
ในโปรตีนโครงสร้างส่วนใหญ่ โครงสร้างทุติยภูมิตัวใดตัวหนึ่งจะมีฤทธิ์เหนือกว่า ซึ่งถูกกำหนดโดยองค์ประกอบของกรดอะมิโน โปรตีนโครงสร้างที่สร้างขึ้นเป็นหลักในรูปแบบของ α-helix คือ α-keratin ขน (ขน) ขนนก ขนนก กรงเล็บ และกีบของสัตว์ประกอบด้วยเคราตินเป็นหลัก เคราติน (ไซโตเคราติน) เป็นส่วนประกอบสำคัญของเส้นใยระดับกลาง จึงเป็นองค์ประกอบสำคัญของโครงร่างโครงร่างเซลล์ ในเคราติน สายโซ่เปปไทด์ส่วนใหญ่จะพับเป็น α-helix สำหรับมือขวา สายเปปไทด์สองสายรวมกันเป็นสายซ้ายเส้นเดียว เกลียวซุปเปอร์ไดเมอร์เคราตินแบบซุปเปอร์คอยล์จะรวมกันเป็นเตตระเมอร์ ซึ่งรวมตัวกันเป็นรูปร่าง โปรโตไฟบริลด้วยเส้นผ่านศูนย์กลาง 3 นาโนเมตร ในที่สุดจะเกิดโปรโตไฟบริลแปดตัว ไมโครไฟเบอร์ด้วยเส้นผ่านศูนย์กลาง 10 นาโนเมตร
เส้นผมถูกสร้างขึ้นจากเส้นใยเดียวกัน ดังนั้นเส้นใยขนสัตว์เส้นเดียวที่มีเส้นผ่านศูนย์กลาง 20 ไมครอนจึงมีเส้นใยหลายล้านเส้นพันกัน เคราตินโซ่แต่ละเส้นเชื่อมโยงกันด้วยพันธะไดซัลไฟด์จำนวนมาก ซึ่งช่วยเพิ่มความแข็งแรงให้กับพวกมัน ในระหว่างการดัดผม กระบวนการต่อไปนี้เกิดขึ้น: ขั้นแรก สะพานไดซัลไฟด์จะถูกทำลายโดยรีดักชันด้วยไทออล จากนั้นเพื่อให้ผมมีรูปร่างตามที่ต้องการ จึงทำให้แห้งด้วยความร้อน ในเวลาเดียวกันเนื่องจากการออกซิเดชั่นของออกซิเจนในอากาศทำให้เกิดสะพานไดซัลไฟด์ใหม่ซึ่งยังคงรูปทรงของทรงผมไว้
ไหมได้มาจากรังไหมของหนอนไหม ( บอมบิกซ์ โมริ) และสายพันธุ์ที่เกี่ยวข้อง โปรตีนหลักของไหม ไฟโบรอินมีโครงสร้างของชั้นที่พับขนานกันและชั้นต่างๆ เองก็วางขนานกัน ก่อตัวเป็นชั้นต่างๆ มากมาย เนื่องจากในโครงสร้างแบบพับ โซ่ด้านข้างของกรดอะมิโนตกค้างจะถูกวางในแนวตั้งขึ้นและลงในแนวตั้ง มีเพียงกลุ่มที่มีขนาดกะทัดรัดเท่านั้นที่สามารถใส่ลงในช่องว่างระหว่างแต่ละชั้นได้ ในความเป็นจริง ไฟโบรอินประกอบด้วยไกลซีน 80% อะลานีน และซีรีน กล่าวคือ กรดอะมิโนสามตัวที่มีขนาดสายด้านข้างน้อยที่สุด โมเลกุลไฟโบรอินประกอบด้วยชิ้นส่วนที่ทำซ้ำโดยทั่วไป (gli-ala-gli-ala-gli-ser)n
โครงสร้างที่ไม่เป็นระเบียบบริเวณของโมเลกุลโปรตีนที่ไม่อยู่ในโครงสร้างที่เป็นเกลียวหรือพับเรียกว่าไม่เป็นระเบียบ
โครงสร้างรองบริเวณโครงสร้างขดลวดอัลฟ่าและเบต้าในโปรตีนสามารถโต้ตอบกันและต่อกันทำให้เกิดชุดประกอบ โครงสร้างเหนือทุติยภูมิที่พบในโปรตีนพื้นเมืองเป็นโครงสร้างที่นิยมใช้กันมากที่สุด ซึ่งรวมถึง α-helix แบบซุปเปอร์คอยล์ โดยที่ α-helices สองตัวบิดสัมพันธ์กัน ทำให้เกิดเป็นซุปเปอร์เฮลิกส์ทางซ้าย (bacteriorhodopsin, hemerythrin); การสลับชิ้นส่วนα-helical และβ-โครงสร้างของสายโซ่โพลีเปปไทด์ (ตัวอย่างเช่นลิงก์βαβαβของ Rossmann ซึ่งพบในบริเวณ NAD + -binding ของโมเลกุลเอนไซม์ดีไฮโดรจีเนส) โครงสร้าง β สามเส้นขนานกัน (βββ) เรียกว่า β-zigzag และพบได้ในเอนไซม์จุลินทรีย์ โปรโตซัว และสัตว์มีกระดูกสันหลังจำนวนหนึ่ง
บทบาทของโปรตีนในร่างกายมีขนาดใหญ่มาก ยิ่งไปกว่านั้น สารสามารถมีชื่อดังกล่าวได้ก็ต่อเมื่อได้รับโครงสร้างที่กำหนดไว้ล่วงหน้าแล้วเท่านั้น จนถึงขณะนี้ มันเป็นโพลีเปปไทด์ ซึ่งเป็นเพียงสายโซ่กรดอะมิโนที่ไม่สามารถทำหน้าที่ตามที่ตั้งใจไว้ได้ โดยทั่วไป โครงสร้างเชิงพื้นที่ของโปรตีน (ปฐมภูมิ ทุติยภูมิ ตติยภูมิ และโดเมน) คือโครงสร้างสามมิติ นอกจากนี้สิ่งที่สำคัญที่สุดสำหรับร่างกายคือโครงสร้างทุติยภูมิ ตติยภูมิ และโดเมน
ข้อกำหนดเบื้องต้นสำหรับการศึกษาโครงสร้างโปรตีน
ในบรรดาวิธีการศึกษาโครงสร้างของสารเคมี การถ่ายภาพด้วยรังสีเอกซ์มีบทบาทพิเศษ คุณสามารถรับข้อมูลเกี่ยวกับลำดับของอะตอมในสารประกอบโมเลกุลและการจัดเรียงเชิงพื้นที่ของพวกมันได้ พูดง่ายๆ ก็คือสามารถถ่ายเอกซเรย์สำหรับโมเลกุลเดี่ยวได้ ซึ่งเกิดขึ้นได้ในช่วงทศวรรษที่ 30 ของศตวรรษที่ 20
ตอนนั้นเองที่นักวิจัยค้นพบว่าโปรตีนหลายชนิดไม่เพียงแต่มีโครงสร้างเชิงเส้นเท่านั้น แต่ยังสามารถอยู่ในส่วนที่เป็นเกลียว ขด และโดเมนอีกด้วย และจากการทดลองทางวิทยาศาสตร์จำนวนมาก ปรากฎว่าโครงสร้างรองของโปรตีนเป็นรูปแบบสุดท้ายสำหรับโปรตีนโครงสร้าง และรูปแบบกลางสำหรับเอนไซม์และอิมมูโนโกลบูลิน ซึ่งหมายความว่าสารที่มีโครงสร้างตติยภูมิหรือควอเทอร์นารีในขั้นตอน "การสุก" จะต้องผ่านขั้นตอนลักษณะการก่อรูปเกลียวของโครงสร้างทุติยภูมิด้วย

การก่อตัวของโครงสร้างโปรตีนทุติยภูมิ
ทันทีที่การสังเคราะห์โพลีเปปไทด์บนไรโบโซมในเครือข่ายหยาบของเอนโดพลาสซึมของเซลล์เสร็จสิ้น โครงสร้างรองของโปรตีนจะเริ่มก่อตัวขึ้น โพลีเปปไทด์นั้นเป็นโมเลกุลยาวซึ่งใช้พื้นที่มากและไม่สะดวกสำหรับการขนส่งและทำหน้าที่ตามที่ตั้งใจไว้ ดังนั้นเพื่อลดขนาดและให้คุณสมบัติพิเศษจึงมีการพัฒนาโครงสร้างรอง สิ่งนี้เกิดขึ้นผ่านการก่อตัวของอัลฟ่าเอนริเก้และแผ่นเบต้า ด้วยวิธีนี้จะได้รับโปรตีนของโครงสร้างทุติยภูมิซึ่งในอนาคตจะกลายเป็นระดับอุดมศึกษาและควอเทอร์นารีหรือจะใช้ในรูปแบบนี้

การจัดโครงสร้างรอง
ตามการศึกษาจำนวนมากได้แสดงให้เห็น โครงสร้างทุติยภูมิของโปรตีนอาจเป็นเกลียวอัลฟาหรือแผ่นเบตา หรือการสลับบริเวณที่มีองค์ประกอบเหล่านี้ นอกจากนี้โครงสร้างทุติยภูมิยังเป็นวิธีการบิดและก่อตัวเป็นเกลียวของโมเลกุลโปรตีน นี่เป็นกระบวนการวุ่นวายที่เกิดขึ้นเนื่องจากพันธะไฮโดรเจนที่เกิดขึ้นระหว่างบริเวณขั้วของกรดอะมิโนที่ตกค้างในโพลีเปปไทด์
โครงสร้างรองของอัลฟ่าเฮลิกส์
เนื่องจากมีเพียงกรด L-amino เท่านั้นที่มีส่วนร่วมในการสังเคราะห์ทางชีวภาพของโพลีเปปไทด์ การก่อตัวของโครงสร้างรองของโปรตีนจึงเริ่มต้นด้วยการบิดเกลียวตามเข็มนาฬิกา (ไปทางขวา) มีกรดอะมิโนตกค้าง 3.6 ตัวอย่างเคร่งครัดต่อการเลี้ยวของขดลวด และระยะห่างตามแกนเกลียวคือ 0.54 นาโนเมตร นี่เป็นคุณสมบัติทั่วไปสำหรับโครงสร้างทุติยภูมิของโปรตีนที่ไม่ขึ้นอยู่กับชนิดของกรดอะมิโนที่เกี่ยวข้องกับการสังเคราะห์

ได้มีการพิจารณาแล้วว่าสายโซ่โพลีเปปไทด์ทั้งหมดไม่ได้เป็นเกลียวอย่างสมบูรณ์ โครงสร้างประกอบด้วยส่วนเชิงเส้น โดยเฉพาะอย่างยิ่งโมเลกุลโปรตีนเปปซินนั้นมีขดลวดเพียง 30% ไลโซไซม์ - 42% และเฮโมโกลบิน - 75% ซึ่งหมายความว่าโครงสร้างทุติยภูมิของโปรตีนไม่ได้เป็นเกลียวอย่างเคร่งครัด แต่เป็นการรวมกันของส่วนต่างๆที่มีเส้นตรงหรือเป็นชั้น
โครงสร้างรองของชั้นเบต้า
โครงสร้างโครงสร้างประเภทที่สองของสารคือชั้นเบต้า ซึ่งเป็นเส้นใยโพลีเปปไทด์ตั้งแต่สองเส้นขึ้นไปที่เชื่อมต่อกันด้วยพันธะไฮโดรเจน อย่างหลังเกิดขึ้นระหว่างกลุ่ม CO NH2 อิสระ ด้วยวิธีนี้โปรตีนโครงสร้าง (กล้ามเนื้อ) ส่วนใหญ่จะเชื่อมต่อกัน
โครงสร้างของโปรตีนประเภทนี้มีดังนี้: สายหนึ่งของโพลีเปปไทด์ที่มีการกำหนดส่วนปลาย A-B นั้นขนานกับอีกเส้นหนึ่ง ข้อแม้เพียงอย่างเดียวคือโมเลกุลที่สองนั้นอยู่ในตำแหน่งตรงกันข้ามและถูกกำหนดให้เป็น BA สิ่งนี้ก่อตัวเป็นชั้นเบต้าซึ่งอาจประกอบด้วยสายโพลีเปปไทด์จำนวนเท่าใดก็ได้ที่เชื่อมต่อกันด้วยพันธะไฮโดรเจนหลายพันธะ
พันธะไฮโดรเจน
โครงสร้างรองของโปรตีนคือพันธะที่เกิดจากปฏิกิริยาหลายขั้วของอะตอมที่มีดัชนีอิเลคโตรเนกาติวีตี้ต่างกัน ธาตุทั้งสี่มีความสามารถสูงสุดในการสร้างพันธะดังกล่าว ได้แก่ ฟลูออรีน ออกซิเจน ไนโตรเจน และไฮโดรเจน โปรตีนมีทุกอย่างยกเว้นฟลูออไรด์ ดังนั้นพันธะไฮโดรเจนสามารถและเกิดขึ้นได้ ทำให้สามารถเชื่อมต่อสายโซ่โพลีเปปไทด์เข้ากับชั้นบีตาและเอนริซอัลฟาได้

วิธีที่ง่ายที่สุดในการอธิบายการเกิดพันธะไฮโดรเจนโดยใช้ตัวอย่างน้ำซึ่งก็คือไดโพล ออกซิเจนมีประจุลบรุนแรง และเนื่องจากมีโพลาไรเซชันสูงของพันธะ OH ไฮโดรเจนจึงถูกพิจารณาว่าเป็นบวก ในสถานะนี้ มีโมเลกุลอยู่ในสภาพแวดล้อมบางอย่าง ยิ่งไปกว่านั้น หลายคนสัมผัสและชนกัน จากนั้นออกซิเจนจากโมเลกุลของน้ำโมเลกุลแรกจะดึงดูดไฮโดรเจนจากอีกโมเลกุลหนึ่ง และต่อไปตามห่วงโซ่
กระบวนการที่คล้ายกันนี้เกิดขึ้นในโปรตีน กล่าวคือ ออกซิเจนอิเล็กโตรเนกาติตีของพันธะเปปไทด์จะดึงดูดไฮโดรเจนจากส่วนใดๆ ของกรดอะมิโนอื่นที่ตกค้าง ทำให้เกิดพันธะไฮโดรเจน นี่คือการผันขั้วแบบอ่อน ซึ่งต้องใช้พลังงานประมาณ 6.3 กิโลจูลจึงจะแตก
จากการเปรียบเทียบ พันธะโควาเลนต์ที่อ่อนที่สุดในโปรตีนต้องใช้พลังงาน 84 กิโลจูลในการแตกตัว พันธะโควาเลนต์ที่แข็งแกร่งที่สุดจะต้องมี 8400 kJ อย่างไรก็ตาม จำนวนพันธะไฮโดรเจนในโมเลกุลโปรตีนนั้นมีมากจนพลังงานทั้งหมดทำให้โมเลกุลดำรงอยู่ในสภาวะที่รุนแรงและรักษาโครงสร้างเชิงพื้นที่ไว้ได้ นี่คือสาเหตุว่าทำไมจึงมีโปรตีน โครงสร้างของโปรตีนประเภทนี้ให้ความแข็งแรงที่จำเป็นสำหรับการทำงานของกล้ามเนื้อ กระดูก และเอ็น โครงสร้างรองของโปรตีนมีความสำคัญต่อร่างกายเป็นอย่างมาก