Calor específico de calentar agua hirviendo. "Hirviendo. Calor específico de vaporización
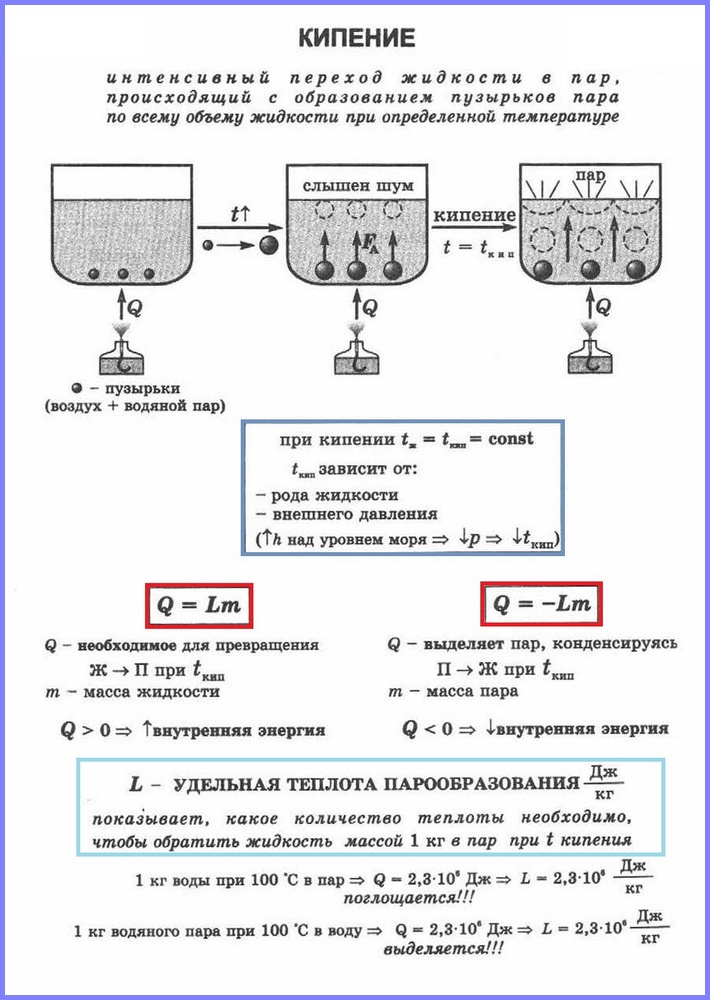
La ebullición es una vaporización intensa que se produce cuando un líquido se calienta no solo desde la superficie, sino también en su interior.
La ebullición se produce con la absorción de calor.
La mayor parte del calor suministrado se gasta en romper los enlaces entre las partículas de la sustancia, el resto en el trabajo realizado durante la expansión del vapor.
Como resultado, la energía de interacción entre las partículas de vapor se vuelve mayor que entre las partículas de líquido, por lo que la energía interna del vapor es mayor que la energía interna del líquido a la misma temperatura.
La cantidad de calor necesaria para convertir el líquido en vapor durante el proceso de ebullición se puede calcular mediante la fórmula:

donde m es la masa del líquido (kg),
L es el calor específico de vaporización.
El calor específico de vaporización muestra cuánto calor se necesita para convertir 1 kg en vapor. de esta sustancia a temperatura de ebullición. Unidad calor específico vaporización en el sistema SI:
[L] = 1 J/kg
Al aumentar la presión, el punto de ebullición del líquido aumenta y el calor específico de vaporización disminuye y viceversa.

Durante la ebullición, la temperatura del líquido no cambia.
El punto de ebullición depende de la presión ejercida sobre el líquido.
Cada sustancia a la misma presión tiene su propio punto de ebullición.
A medida que aumenta la presión atmosférica, la ebullición comienza a más temperatura alta, cuando la presión disminuye, es al revés.
Por ejemplo, el agua hierve a 100 °C sólo a presión atmosférica normal.
¿QUÉ PASA DENTRO DE UN LÍQUIDO AL HERVIR?

La ebullición es la transición de un líquido a vapor con la formación y crecimiento continuo de burbujas de vapor en el líquido, en las que el líquido se evapora. Al inicio del calentamiento, el agua está saturada de aire y se encuentra a temperatura ambiente. Cuando se calienta el agua, el gas disuelto en ella se libera en el fondo y las paredes del recipiente, formando burbujas de aire. Comienzan a aparecer mucho antes de hervir. El agua se evapora en estas burbujas. Una burbuja llena de vapor comienza a hincharse a una temperatura suficientemente alta.

Al alcanzar un cierto tamaño, se desprende del fondo, sube a la superficie del agua y estalla. En este caso, el vapor sale del líquido. Si el agua no se calienta lo suficiente, la burbuja de vapor que se eleva hacia las capas frías colapsa. Las vibraciones resultantes del agua provocan la aparición de una gran cantidad de pequeñas burbujas de aire en todo el volumen de agua: la llamada "llave blanca".

Una fuerza de elevación actúa sobre una burbuja de aire con un volumen en el fondo del recipiente:
Funder = Farchimedes - Fgravity
La burbuja se presiona hacia el fondo porque no actúan fuerzas de presión sobre la superficie inferior. Cuando se calienta, la burbuja se expande debido a la liberación de gas en ella y se desprende del fondo cuando la fuerza de elevación es ligeramente mayor que la fuerza de presión. El tamaño de la burbuja que puede desprenderse del fondo depende de su forma. La forma de las burbujas en el fondo está determinada por la humectabilidad del fondo del recipiente.
La falta de homogeneidad de la humectación y la fusión de las burbujas en el fondo provocó un aumento de su tamaño. En tallas grandes A medida que la burbuja asciende, detrás de ella se forman vacíos, rupturas y turbulencias.
Cuando una burbuja estalla, todo el líquido que la rodea entra corriendo, creando una onda anular. Al cerrarse, arroja una columna de agua.

Cuando las burbujas estallan, se propagan en el líquido ondas de choque de frecuencias ultrasónicas, acompañadas de un ruido audible. Para etapas iniciales La ebullición se caracteriza por los sonidos más fuertes y agudos (en la etapa de "tecla blanca", la tetera "canta").
(fuente: virlib.eunnet.net)
CALENDARIO DE CAMBIOS DE TEMPERATURA EN LOS ESTADOS DEL AGUA

¡MIRA LA ESTANTERIA!
INTERESANTE
¿Por qué hacen un agujero en la tapa de la tetera?
Para liberar vapor. Sin un orificio en la tapa, el vapor puede salpicar agua por la salida del hervidor.
___
La duración de la cocción de las patatas, a partir del momento de hervir, no depende de la potencia del calentador. La duración está determinada por el tiempo que el producto permanece en el punto de ebullición.
La potencia del calentador no afecta el punto de ebullición, solo afecta la velocidad de evaporación del agua.
Hervir puede hacer que el agua se congele. Para hacer esto, es necesario bombear aire y vapor de agua del recipiente donde se encuentra el agua, para que el agua hierva todo el tiempo.
"Las ollas hierven fácilmente hasta el borde: ¡mal tiempo!"
La caída de la presión atmosférica que acompaña al empeoramiento del tiempo es la razón por la que la leche “se escapa” más rápido.
___
Se puede obtener agua hirviendo muy caliente en el fondo de las minas profundas, donde la presión del aire es mucho mayor que en la superficie de la Tierra. Entonces, a una profundidad de 300 m, el agua hervirá a 101 ͦ C. A una presión de aire de 14 atmósferas, el agua hierve a 200 ͦ C.
bajo la campana bomba de aire se puede obtener “agua hirviendo” a 20 ͦ C.
En Marte beberíamos “agua hirviendo” a 45 ͦ C.
El agua salada hierve a temperaturas superiores a 100 ͦ C. ___
En las regiones montañosas a gran altura y con baja presión atmosférica, el agua hierve a temperaturas inferiores a 100 ͦ Celsius.

Se necesita más tiempo para esperar a que se cocine una comida así.
Echa un poco de agua fría... ¡y hervirá!
Normalmente el agua hierve a 100 grados centígrados. Calentar el agua del matraz a fuego lento hasta que hierva. Apaguemos el fuego. El agua deja de hervir. Cierre el matraz con un tapón y comience a verter con cuidado agua fría sobre el tapón en un chorro. ¿Cómo es? ¡El agua vuelve a hervir!
..............................bajo la corriente agua fría el agua en el matraz, y con ella el vapor de agua comienza a enfriarse.
El volumen de vapor disminuye y la presión sobre la superficie del agua cambia...
¿En qué dirección crees?
... ¡El punto de ebullición del agua a presión reducida es inferior a 100 grados y el agua del matraz vuelve a hervir!
____
Al cocinar, la presión dentro de la sartén (olla a presión) es de aproximadamente 200 kPa, y la sopa en dicha sartén se cocinará mucho más rápido.
Puede llenar la jeringa con agua hasta aproximadamente la mitad, cerrarla con el mismo tapón y tirar bruscamente del émbolo. Aparecerá una masa de burbujas en el agua, lo que indica que ha comenzado el proceso de ebullición del agua (¡y esto es a temperatura ambiente!).
___
Cuando una sustancia pasa al estado gaseoso, su densidad disminuye unas 1000 veces.
___
Los primeros hervidores eléctricos tenían calentadores debajo. El agua no entró en contacto con el calentador y tardó mucho en hervir. En 1923, Arthur Large hizo un descubrimiento: colocó un calentador en un tubo de cobre especial y lo colocó dentro de una tetera. El agua hervía rápidamente.
En EE.UU. se han desarrollado latas autoenfriables para refrescos. En el frasco hay un compartimento con un líquido de bajo punto de ebullición. Si trituras la cápsula en un día caluroso, el líquido comenzará a hervir rápidamente, quitando calor al contenido del frasco, y en 90 segundos la temperatura de la bebida bajará entre 20 y 25 grados centígrados.
BUENO, ¿POR QUÉ?
¿Qué piensas, es posible hervir un huevo si el agua hierve a una temperatura inferior a 100 grados centígrados?
____
¿Hervirá el agua en una olla que está flotando en otra olla con agua hirviendo?
¿Por qué? ___
¿Es posible hacer hervir agua sin calentarla?

Capacidad calorífica específica
El calor específico es la cantidad de calor en julios (J) necesaria para elevar la temperatura de una sustancia. La capacidad calorífica específica es función de la temperatura. Para los gases, es necesario distinguir entre capacidad calorífica específica a presión constante y a volumen constante.
Calor específico de fusión
El calor específico de fusión de un sólido es la cantidad de calor en J necesaria para convertir 1 kg de una sustancia de sólido a líquido en su punto de fusión.
Calor latente de vaporización
El calor latente de vaporización de un líquido es la cantidad de calor en J necesaria para evaporar 1 kg de líquido en su punto de ebullición. El calor latente de vaporización depende en gran medida de la presión. Ejemplo: si se aplica calor a un recipiente que contiene 1 kg de agua a 100 °C (al nivel del mar), el agua absorberá 1023 kJ de calor latente sin ningún cambio en la lectura del termómetro. Sin embargo, habrá un cambio en el estado de agregación de líquido a vapor. El calor absorbido por el agua se llama calor latente de vaporización.
El vapor retendrá 1023 kJ, ya que esta energía fue necesaria para cambiar el estado de agregación.
Calor latente de condensación
En el proceso inverso, cuando se elimina calor de 1 kg de vapor de agua a 100°C (al nivel del mar), el vapor liberará 1023 kJ de calor sin cambiar la lectura del termómetro. Sin embargo, habrá un cambio en el estado de agregación de vapor a líquido. El calor absorbido por el agua se llama calor latente de condensación.

Temperatura y presión
Mediciones térmicas La temperatura, o INTENSIDAD del calor, se mide con un termómetro. La mayoría de las temperaturas en este manual se expresan en grados Celsius (C), pero a veces se utilizan grados Fahrenheit (F)." - la temperatura a la que se elimina todo el calor del cuerpo. La temperatura del cero absoluto se define como –273°C. Cualquier sustancia a una temperatura superior al cero absoluto contiene algo de calor. Para comprender los conceptos básicos del aire acondicionado, también es necesario comprender la relación entre presión, temperatura y estado de la materia. Nuestro planeta está rodeado de aire, es decir, de gas. La presión en el gas se transmite por igual en todas las direcciones. El gas que nos rodea se compone de un 21% de oxígeno y un 78% de nitrógeno.
El 1% restante lo ocupan otros gases raros. Esta combinación de gases se llama atmósfera. Se extiende varios cientos de kilómetros sobre la superficie terrestre y está sostenido por la gravedad. Al nivel del mar, la presión atmosférica es de 1,0 bar y el punto de ebullición del agua es de 100°C.
En cualquier punto sobre el nivel del mar, la presión atmosférica es menor, al igual que el punto de ebullición del agua. Cuando la presión cae a 0,38 bar, el punto de ebullición del agua es 75°C y a una presión de 0,12 bar es 50°C.
Si el punto de ebullición del agua se ve afectado por una disminución de la presión, es lógico suponer que un aumento de la presión también lo afectará. ¡Un ejemplo es una caldera de vapor! Información adicional: Cómo convertir Fahrenheit a Celsius y viceversa: C = 5/9 × (F – 32). F = (9/5 × C)+32. Kelvin = C + 273. Rankine = F + 460.
Cuando se calienta, la temperatura del agua sube a cien grados. Después de cien grados, con un mayor calentamiento, la temperatura del vapor de agua aumentará. Pero hasta que toda el agua hierva a cien grados, su temperatura no aumentará, por mucha energía que apliques. Ya hemos descubierto adónde va esta energía: a la transición del agua a un estado gaseoso. Pero dado que tal fenómeno existe, significa que debe haber describiendo este fenómeno cantidad fisica. Y ese valor existe. Se llama calor específico de vaporización.
Calor específico de vaporización del agua.
El calor específico de vaporización es una cantidad física que muestra la cantidad de calor necesaria para convertir un líquido que pesa 1 kg en vapor en el punto de ebullición. El calor específico de vaporización se designa con la letra L. Y la unidad de medida es el julio por kilogramo (1 J/kg).
El calor específico de vaporización se puede encontrar con la fórmula:
donde Q es la cantidad de calor,
m es el peso corporal.
Por cierto, la fórmula es la misma que para calcular el calor específico de fusión, la única diferencia está en la designación. λ y L
Se encontraron experimentalmente los valores del calor específico de vaporización de diversas sustancias y se compilaron tablas a partir de las cuales se pueden encontrar datos para cada sustancia. Por tanto, el calor específico de vaporización del agua es igual a 2,3*106 J/kg. Esto significa que por cada kilogramo de agua es necesario gastar una cantidad de energía igual a 2,3 * 106 J para convertirla en vapor. Pero al mismo tiempo el agua ya debe tener el punto de ebullición. Si el agua estaba inicialmente a una temperatura más baja, entonces es necesario calcular la cantidad de calor que se necesitará para calentar el agua a cien grados.
En condiciones reales, a menudo es necesario determinar la cantidad de calor necesaria para transformación de una determinada masa de cualquier líquido en vapor, por lo tanto, más a menudo hay que lidiar con una fórmula de la forma: Q = Lm, y los valores del calor específico de vaporización para una sustancia específica se toman de tablas ya preparadas.
De los §§ 2.5 y 7.2 se deduce que durante la vaporización la energía interna de una sustancia aumenta y durante la condensación disminuye. Dado que durante estos procesos las temperaturas del líquido y su vapor pueden ser iguales, el cambio en la energía interna de una sustancia se produce sólo debido a un cambio en la energía potencial de las moléculas. Entonces, a la misma temperatura, una unidad de masa de líquido tiene menos energía interna que una unidad de masa de su vapor.
La experiencia muestra que la densidad de una sustancia durante la vaporización disminuye considerablemente y el volumen ocupado por la sustancia aumenta. Por lo tanto, durante la vaporización, se debe trabajar contra fuerzas de presión externas. Por tanto, la energía que se debe impartir a un líquido para transformarlo en vapor a temperatura constante se utiliza en parte para aumentar la energía interna de la sustancia y en parte para realizar trabajo contra fuerzas externas en el proceso de su expansión.
En la práctica, para convertir un líquido en vapor durante el proceso de intercambio de calor, se le suministra calor. La cantidad de calor necesaria para convertir un líquido en vapor a temperatura constante se llama calor de vaporización. Cuando el vapor se convierte en líquido, es necesario extraerle una cantidad de calor, lo que se denomina calor de condensación. Si las condiciones externas son las mismas, entonces con masas iguales de la misma sustancia, el calor de vaporización es igual al calor de condensación.
Usando un calorímetro, se encontró que el calor de vaporización es directamente proporcional a la masa de líquido convertido en vapor.
Aquí está el coeficiente de proporcionalidad, cuyo valor depende del tipo de líquido y condiciones externas.
La cantidad que caracteriza la dependencia del calor de vaporización del tipo de sustancia y de las condiciones externas se denomina calor específico de vaporización. El calor específico de vaporización se mide por la cantidad de calor necesaria para convertir una unidad de masa de líquido en vapor a temperatura constante:
En el SI, la unidad se considera el calor específico de vaporización de un líquido que requiere 1 J de calor para convertir 1 kg de líquido en vapor a temperatura constante. (Muestre esto usando la fórmula (7.1a).)
Como ejemplo, observamos que el calor específico de vaporización del agua a una temperatura (100°C) es igual a
Dado que la vaporización puede ocurrir cuando diferentes temperaturas, surge la pregunta: ¿cambiará el calor específico de vaporización de la sustancia? La experiencia demuestra que a medida que aumenta la temperatura, disminuye el calor específico de vaporización. Esto sucede porque todos los líquidos se expanden cuando se calientan. La distancia entre las moléculas aumenta y las fuerzas de interacción molecular disminuyen. Además, cuanto mayor es la temperatura, mayor es la energía promedio de las moléculas del líquido y menos energía necesitan agregar para poder volar más allá de la superficie del líquido.
El fenómeno por el cual una sustancia pasa del estado líquido al estado gaseoso se llama vaporización. La vaporización se puede realizar en forma de dos procesos: i.
Hirviendo
El segundo proceso de vaporización es la ebullición. Puedes observar este proceso usando experiencia sencilla calentando agua en un matraz de vidrio. Cuando se calienta el agua, después de un tiempo aparecen burbujas que contienen aire y vapor de agua saturado, que se forma cuando el agua se evapora dentro de las burbujas. A medida que aumenta la temperatura, aumenta la presión dentro de las burbujas y, bajo la acción de una fuerza de flotación, se elevan hacia arriba. Sin embargo, dado que la temperatura capas superiores Hay menos agua que las inferiores, el vapor de las burbujas comienza a condensarse y se encogen. Cuando el agua se calienta en todo el volumen, las burbujas de vapor suben a la superficie, estallan y sale vapor. El agua está hirviendo. Esto ocurre a una temperatura en la que la presión del vapor saturado en las burbujas es igual a la presión atmosférica.
Se llama proceso de vaporización que se produce en todo el volumen de un líquido a una determinada temperatura. La temperatura a la que hierve un líquido se llama punto de ebullición.
Esta temperatura depende de la presión atmosférica. A medida que aumenta la presión atmosférica, aumenta el punto de ebullición.
La experiencia demuestra que durante el proceso de ebullición la temperatura del líquido no cambia, a pesar de que la energía proviene del exterior. La transición de un líquido a un estado gaseoso en el punto de ebullición está asociada a un aumento de la distancia entre las moléculas y, en consecuencia, a la superación de la atracción entre ellas. La energía suministrada al líquido se consume para realizar un trabajo para superar las fuerzas de atracción. Esto sucede hasta que todo el líquido se convierte en vapor. Dado que el líquido y el vapor tienen la misma temperatura durante la ebullición, la energía cinética promedio de las moléculas no cambia, solo aumenta su energía potencial.
La figura muestra un gráfico de la dependencia de la temperatura del agua con el tiempo durante su calentamiento desde temperatura ambiente hasta el punto de ebullición (AB), punto de ebullición (BC), calentamiento con vapor (CD), enfriamiento con vapor (DE), condensación (EF) y posterior enfriamiento (FG).
Calor específico de vaporización
Para transformar diferentes sustancias de un estado líquido a gaseoso se requiere energía diferente, esta energía se caracteriza por un valor llamado calor específico de vaporización.
Calor específico de vaporización (l) es un valor igual a la relación entre la cantidad de calor que se debe impartir a una sustancia que pesa 1 kg para transformarla de un estado líquido a un estado gaseoso en el punto de ebullición.
Unidad de calor específico de vaporización - [ l] = J/kg.
Para calcular la cantidad de calor Q que se debe impartir a una sustancia con masa mn para su transformación de estado líquido a gaseoso, se utiliza el calor específico de vaporización ( l) multiplicado por la masa de la sustancia: Q = Lm.
Cuando el vapor se condensa, se libera una cierta cantidad de calor, y su valor es igual a la cantidad de calor que se debe gastar para convertir el líquido en vapor a la misma temperatura.