Цилиндрична протеинова структура. Вторичната структура на протеина е двойна. Протеини: общо понятие
За всеки протеин, освен основния, има и определен вторична структура. Обикновено протеинова молекуланаподобява удължена пружина.
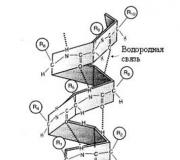
Това е така наречената а-спирала, стабилизирана от много водородни връзки, които възникват между CO и NH групите, разположени наблизо. Водороден атом от NH групаедна аминокиселина образува такава връзка с кислородния атом на СО групата на друга аминокиселина, отделена от първата с четири аминокиселинни остатъка.
По този начин аминокиселина 1 се оказва свързана с аминокиселина 5, аминокиселина 2 с аминокиселина 6 и т.н. Рентгеновият структурен анализ показва, че има 3,6 аминокиселинни остатъка на завъртане на спиралата.
Напълно а-спирална конформацияи следователно кератиновият протеин има фибриларна структура. Това е структурно протеинкоса, вълна, нокти, клюн, пера и рога, който също е част от кожата на гръбначните животни.
Твърдост и разтегливост на кератинаварират в зависимост от броя на дисулфидните мостове между съседни полипептидни вериги (степента на омрежване на веригите).
Теоретично във формирането могат да участват всички CO и NH групи водородни връзки, така че α-спиралата е много стабилна и следователно много често срещана конформация. Секциите на α-спиралата в молекулата приличат на твърди пръчки. Повечето протеини обаче съществуват в глобуларна форма, която също съдържа региони (3 слоя (вижте по-долу) и региони с неправилна структура.
Това се обяснява с факта, че образованието водородни връзкиредица фактори възпрепятстват това: наличието на определени аминокиселинни остатъци в полипептидната верига, наличието на дисулфидни мостове между различни участъци на същата верига и накрая фактът, че аминокиселината пролин обикновено не е в състояние да образува водородни връзки. .
Бета слой, или нагънат слойе друг вид вторична структура. Коприненият протеин фиброин, секретиран от копринените жлези на гъсениците на копринената буба при свиване на пашкули, е представен изцяло в тази форма. Фиброинът се състои от редица полипептидни вериги, които са по-удължени от веригите с алфа конформация. спирали.
Тези вериги са положени успоредно, но съседните вериги са противоположни по посока една на друга (антипаралелни). Те са свързани помежду си с помощта на водородни връзки, възникващи между C=0- и NH-групите на съседни вериги. В този случай всички NH и C=0 групи също участват в образуването на водородни връзки, т.е. структурата също е много стабилна.
Тази конформация на полипептидните вериги се нарича бета конформация, а структурата като цяло е нагънат слой. Има висока якост на опън и не може да се разтяга, но тази организация на полипептидните вериги прави коприната много гъвкава. В глобуларните протеини полипептидната верига може да се сгъне върху себе си и тогава в тези точки на глобулите се появяват области, които имат структурата на нагънат слой.
Друг метод за организиране на полипептидни веригинамираме във фибриларния протеин колаген. Това също е структурен протеин, който, подобно на кератина и фиброина, има висока якост на опън. Колагенът има три полипептидни вериги, усукани заедно, като нишки във въже, образуващи тройна спирала. Всяка полипептидна верига от тази сложна спирала, наречена тропоколаген, съдържа около 1000 аминокиселинни остатъка. Отделна полипептидна верига е свободна навита спирала(но не а-спирала;).
Три вериги, държани заедно водородни връзки. Фибрилите се образуват от много тройни спирали, разположени успоредно една на друга и държани заедно чрез ковалентни връзки между съседни вериги. Те от своя страна се свързват във влакна. Така структурата на колагена се формира на етапи - на няколко нива - подобно на структурата на целулозата. Колагенът също не може да се разтяга и това свойство е от съществено значение за функцията, която изпълнява например в сухожилията, костите и други видове съединителна тъкан.
катерици, съществуващи само в напълно навита форма, като кератин и колаген, са изключение сред другите протеини.
водородни връзки
Разграничете a-спирала, b-структура (кълбо).
Структура α-спирали беше предложено ПолингИ Кори

колаген
б-Структура
Ориз. 2.3. б-Структура
Структурата има плоска форма паралелна b-структура; ако обратното - антипаралелна b-структура
супер спирала. протофибрили микрофибрилис диаметър 10 nm.
Bombyx mori фиброин
Нарушена конформация.
Надвторична структура.
ВИЖ ПОВЕЧЕ:
СТРУКТУРНА ОРГАНИЗАЦИЯ НА БЕЛТЪЦИТЕ
Доказано е съществуването на 4 нива на структурна организация на една белтъчна молекула.
Първична протеинова структура– последователността на подреждане на аминокиселинните остатъци в полипептидната верига. В протеините отделните аминокиселини са свързани една с друга пептидни връзки, възникващи от взаимодействието на а-карбоксилни и а-амино групи на аминокиселини.

Към днешна дата е дешифрирана първичната структура на десетки хиляди различни протеини. За да се определи първичната структура на протеина, аминокиселинният състав се определя с помощта на методи на хидролиза. След това се определя химическата природа на крайните аминокиселини. Следващата стъпка е определяне на последователността на аминокиселините в полипептидната верига. За тази цел се използва селективна частична (химична и ензимна) хидролиза. Възможно е да се използва рентгенов дифракционен анализ, както и данни за комплементарната нуклеотидна последователност на ДНК.
Вторична структура на протеина– конфигурация на полипептидната верига, т.е. метод за опаковане на полипептидна верига в специфична конформация. Този процес не протича хаотично, а в съответствие с програмата, заложена в първичната структура.
Стабилността на вторичната структура се осигурява главно от водородни връзки, но известен принос имат и ковалентните връзки - пептидни и дисулфидни.
Разглежда се най-вероятният тип структура на глобуларните протеини а-спирала. Усукването на полипептидната верига става по посока на часовниковата стрелка. Всеки протеин се характеризира с определена степен на спирализация. Ако хемоглобиновите вериги са 75% спирални, тогава пепсинът е само 30%.
Типът конфигурация на полипептидните вериги, открити в протеините на косата, коприната и мускулите, се нарича б-структури.
Сегментите на пептидната верига са подредени в един слой, образувайки фигура, подобна на сгънат на акордеон лист. Слоят може да бъде образуван от две или повече пептидни вериги.
В природата има протеини, чиято структура не съответства нито на β-, нито на a-структурата, например колагенът е фибриларен протеин, който съставлява по-голямата част от съединителната тъкан в човешкото и животинското тяло.
Третична структура на протеина– пространствена ориентация на полипептидната спирала или начинът, по който полипептидната верига е разположена в определен обем. Първият протеин, чиято третична структура е изяснена чрез рентгенов дифракционен анализ, е миоглобинът на кашалота (фиг. 2).
При стабилизирането на пространствената структура на протеините, освен ковалентните връзки, основна роля играят нековалентните връзки (водородни, електростатични взаимодействия на заредени групи, междумолекулни ван дер ваалсови сили, хидрофобни взаимодействия и др.).
Според съвременните концепции третичната структура на протеина след завършване на неговия синтез се образува спонтанно. Основната движеща сила е взаимодействието на аминокиселинните радикали с водните молекули. В този случай неполярните хидрофобни аминокиселинни радикали са потопени вътре в протеиновата молекула, а полярните радикали са ориентирани към водата. Процесът на образуване на естествената пространствена структура на полипептидна верига се нарича сгъване. Протеините, наречени придружители.Те участват в сгъването. Описани са редица наследствени заболявания на човека, чието развитие е свързано с нарушения, дължащи се на мутации в процеса на сгъване (пигментоза, фиброза и др.).
С помощта на методите за рентгенов дифракционен анализ е доказано съществуването на нива на структурна организация на белтъчната молекула, междинни между вторичната и третичната структура. Домейне компактна глобуларна структурна единица в полипептидна верига (фиг. 3). Открити са много протеини (например имуноглобулини), състоящи се от домени с различна структура и функции, кодирани от различни гени.
Всички биологични свойства на протеините са свързани със запазването на тяхната третична структура, която се нарича местен. Белтъчната глобула не е абсолютно твърда структура: възможни са обратими движения на части от пептидната верига. Тези промени не нарушават цялостната конформация на молекулата. Конформацията на протеиновата молекула се влияе от pH на околната среда, йонната сила на разтвора и взаимодействието с други вещества. Всички влияния, водещи до нарушаване на нативната конформация на молекулата, са придружени от частична или пълна загуба на биологичните свойства на протеина.
Кватернерна протеинова структура- метод за полагане в пространството на отделни полипептидни вериги, които имат еднаква или различна първична, вторична или третична структура, и образуването на структурно и функционално единна макромолекулна формация.
Нарича се белтъчна молекула, състояща се от няколко полипептидни вериги олигомер, и всяка верига, включена в него - протомер. Олигомерните протеини често са изградени от четен брой протомери, например, молекулата на хемоглобина се състои от две а- и две b-полипептидни вериги (фиг. 4).
Около 5% от протеините имат кватернерна структура, включително хемоглобин и имуноглобулини. Структурата на субединицата е характерна за много ензими.
Протеиновите молекули, които изграждат протеин с кватернерна структура, се образуват отделно върху рибозомите и едва след завършване на синтеза образуват обща супрамолекулна структура. Протеинът придобива биологична активност само когато съставните му протомери се комбинират. В стабилизирането на кватернерната структура участват същите видове взаимодействия, както и в стабилизирането на третичната структура.
Някои изследователи признават съществуването на пето ниво на структурна организация на протеина. Това метаболизъм -полифункционални макромолекулни комплекси от различни ензими, които катализират целия път на субстратни трансформации (синтетази на висши мастни киселини, пируват дехидрогеназен комплекс, дихателна верига).
Вторична структура на протеина
Вторичната структура е начинът, по който полипептидната верига е подредена в подредена структура. Вторичната структура се определя от първичната структура. Тъй като първичната структура е генетично определена, образуването на вторична структура може да възникне, когато полипептидната верига напусне рибозомата. Вторичната структура е стабилизирана водородни връзки, които се образуват между NH и CO групите на пептидните връзки.
Разграничете a-спирала, b-структураи нарушена конформация (кълбо).
Структура α-спирали беше предложено ПолингИ Кори(1951 г.). Това е вид протеинова вторична структура, която изглежда като правилна спирала (фиг. 2.2). α-спиралата е пръчковидна структура, в която пептидните връзки са разположени вътре в спиралата, а аминокиселинните радикали на страничната верига са разположени отвън. А-спиралата се стабилизира от водородни връзки, които са успоредни на оста на спиралата и се срещат между първия и петия аминокиселинен остатък. По този начин, в разширени спирални области, всеки аминокиселинен остатък участва в образуването на две водородни връзки.

Ориз. 2.2. Структура на α-спирала.
Има 3,6 аминокиселинни остатъка на завъртане на спиралата, стъпката на спиралата е 0,54 nm и има 0,15 nm на аминокиселинен остатък. Ъгълът на спиралата е 26°. Периодът на редовност на a-спирала е 5 завъртания или 18 аминокиселинни остатъка. Най-разпространени са десните а-спирали, т.е. Спиралата се завърта по посока на часовниковата стрелка. Образуването на а-спирала се предотвратява от пролин, аминокиселини със заредени и обемисти радикали (електростатични и механични препятствия).
Друга спираловидна форма присъства в колаген . В тялото на бозайниците колагенът е количествено преобладаващият протеин: той съставлява 25% от общия протеин. Колагенът присъства в различни форми, предимно в съединителната тъкан. Това е лява спирала със стъпка от 0,96 nm и 3,3 остатъка на завъртане, по-плоска от α-спиралата. За разлика от α-спиралата, тук е невъзможно образуването на водородни мостове. Колагенът има необичаен аминокиселинен състав: 1/3 е глицин, приблизително 10% пролин, както и хидроксипролин и хидроксилизин. Последните две аминокиселини се образуват след биосинтеза на колаген чрез посттранслационна модификация. В структурата на колагена триплетът gly-X-Y постоянно се повтаря, като позицията X често е заета от пролин, а позицията Y от хидроксилизин. Има добри доказателства, че колагенът присъства повсеместно като дясна тройна спирала, усукана от три първични леви спирали. В тройна спирала всеки трети остатък завършва в центъра, където по пространствени причини се вписва само глицинът. Цялата колагенова молекула е с дължина около 300 nm.
б-Структура(b-нагънат слой). Намира се в глобуларни протеини, както и в някои фибриларни протеини, например копринен фиброин (фиг. 2.3).
Ориз. 2.3. б-Структура
Структурата има плоска форма. Полипептидните вериги са почти напълно удължени, а не плътно усукани, както при a-спирала. Равнините на пептидните връзки са разположени в пространството като еднакви гънки на лист хартия.
Вторична структура на полипептиди и протеини
Той се стабилизира чрез водородни връзки между CO и NH групите на пептидните връзки на съседни полипептидни вериги. Ако полипептидните вериги, образуващи b-структурата, вървят в една и съща посока (т.е. C- и N-краищата съвпадат) – паралелна b-структура; ако обратното - антипаралелна b-структура. Страничните радикали на един слой се поставят между страничните радикали на друг слой. Ако една полипептидна верига се огъне и върви успоредно на себе си, тогава това антипаралелна b-кръстосана структура. Водородните връзки в b-кръстосаната структура се образуват между пептидните групи на бримките на полипептидната верига.
Съдържанието на а-спирали в изследваните до момента протеини е изключително променливо. В някои протеини, например миоглобин и хемоглобин, а-спиралата е в основата на структурата и представлява 75%, в лизозима - 42%, в пепсина само 30%. Други протеини, например храносмилателният ензим химотрипсин, практически са лишени от а-спирална структура и значителна част от полипептидната верига се вписва в слоести b-структури. Поддържащите тъканни протеини колаген (протеин на сухожилията и кожата), фиброин (естествен копринен протеин) имат b-конфигурация на полипептидни вериги.
Доказано е, че образуването на α-спирали се улеснява от glu, ala, leu, а β-структурите от met, val, ile; на местата, където полипептидната верига се огъва - gly, pro, asn. Смята се, че шест групирани остатъка, четири от които допринасят за образуването на спиралата, могат да се считат за център на спирализиране. От този център има растеж на спирали в двете посоки до участък - тетрапептид, състоящ се от остатъци, които предотвратяват образуването на тези спирали. По време на образуването на β-структурата ролята на праймери се изпълнява от три от пет аминокиселинни остатъка, които допринасят за образуването на β-структурата.
В повечето структурни протеини преобладава една от вторичните структури, което се определя от техния аминокиселинен състав. Структурен протеин, изграден предимно под формата на α-спирала, е α-кератин. Животинските косми (козина), пера, пера, нокти и копита са съставени основно от кератин. Като компонент на междинните филаменти, кератинът (цитокератин) е основен компонент на цитоскелета. В кератините по-голямата част от пептидната верига е нагъната в дясна α-спирала. Две пептидни вериги образуват една лява супер спирала.Суперспиралните кератинови димери се комбинират в тетрамери, които се агрегират, за да се образуват протофибрилис диаметър 3 nm. Накрая се образуват осем протофибрили микрофибрилис диаметър 10 nm.
Косата е изградена от същите фибрили. Така в едно вълнено влакно с диаметър 20 микрона се преплитат милиони фибрили. Индивидуалните кератинови вериги са омрежени чрез множество дисулфидни връзки, което им придава допълнителна здравина. По време на къдрене протичат следните процеси: първо дисулфидните мостове се разрушават чрез редукция с тиоли и след това, за да се придаде необходимата форма на косата, тя се изсушава чрез нагряване. В същото време, поради окисление от кислорода на въздуха, се образуват нови дисулфидни мостове, които запазват формата на прическата.
Коприната се получава от пашкули на гъсеници на копринени буби ( Bombyx mori) и сродни видове. Основният протеин на коприната, фиброин, има структурата на антипаралелен сгънат слой, а самите слоеве са разположени успоредно един на друг, образувайки множество слоеве. Тъй като в нагънатите структури страничните вериги на аминокиселинните остатъци са ориентирани вертикално нагоре и надолу, само компактни групи могат да се поберат в пространствата между отделните слоеве. Всъщност фиброинът се състои от 80% глицин, аланин и серин, т.е. три аминокиселини, характеризиращи се с минимален размер на страничната верига. Молекулата на фиброина съдържа типичен повтарящ се фрагмент (gli-ala-gli-ala-gli-ser)n.
Нарушена конформация.Регионите на протеинова молекула, които не принадлежат към спираловидни или нагънати структури, се наричат неподредени.
Надвторична структура.Алфа спиралните и бета структурните области в протеините могат да взаимодействат помежду си и помежду си, образувайки сглобки. Супра-вторичните структури, открити в естествените протеини, са енергийно най-предпочитани. Те включват суперспирална α-спирала, в която две α-спирали са усукани една спрямо друга, образувайки лява суперспирала (бактериородопсин, хемеритрин); редуващи се α-спирални и β-структурни фрагменти на полипептидната верига (например, βαβαβ връзката на Rossmann, намерена в NAD+-свързващия регион на ензимни молекули дехидрогеназа); антипаралелната триверижна β структура (βββ) се нарича β-зигзаг и се намира в редица микробни, протозойни и гръбначни ензими.
Предишна234567891011121314151617Следваща
ВИЖ ПОВЕЧЕ:
Вторична структура на протеините
Пептидните вериги на протеините са организирани във вторична структура, стабилизирана от водородни връзки. Кислородният атом на всяка пептидна група образува водородна връзка с NH групата, съответстваща на пептидната връзка. В този случай се образуват следните структури: a-спирала, b-структура и b-завой. а-спирала.Една от най-термодинамично благоприятните структури е дясната α-спирала. a-спирала, представляваща стабилна структура, в която всяка карбонилна група образува водородна връзка с четвъртата NH група по веригата.
Протеини: Вторична структура на протеини
В една α-спирала има 3,6 аминокиселинни остатъка на завой, стъпката на спиралата е приблизително 0,54 nm, а разстоянието между остатъците е 0,15 nm. L-аминокиселините могат да образуват само десни α-спирали, като страничните радикали са разположени от двете страни на оста и са обърнати навън. В а-спиралата се използва напълно възможността за образуване на водородни връзки, следователно, за разлика от b-структурата, тя не е в състояние да образува водородни връзки с други елементи на вторичната структура. Когато се образува α-спирала, страничните вериги на аминокиселините могат да се приближат една до друга, образувайки хидрофобни или хидрофилни компактни места. Тези места играят значителна роля при формирането на триизмерната конформация на протеиновата макромолекула, тъй като се използват за опаковане на α-спирали в пространствената структура на протеина. Спирална топка.Съдържанието на а-спирали в белтъците не е еднакво и е индивидуална особеност на всяка протеинова макромолекула. Някои протеини, като миоглобин, имат α-спирала като основа на тяхната структура; други, като химотрипсин, нямат α-спирални области. Средно глобуларните протеини имат степен на спирализиране от порядъка на 60-70%. Спирализираните участъци се редуват с хаотични намотки и в резултат на денатурацията се увеличават преходите спирала-намотка. Спирализацията на полипептидната верига зависи от аминокиселинните остатъци, които я образуват. Така разположените в непосредствена близост една до друга отрицателно заредени групи от глутаминова киселина изпитват силно взаимно отблъскване, което предотвратява образуването на съответните водородни връзки в α-спиралата. По същата причина верижната спирализация е възпрепятствана поради отблъскването на близко разположени положително заредени химически групи от лизин или аргинин. Големият размер на аминокиселинните радикали също е причина за затруднено спирализиране на полипептидната верига (серин, треонин, левцин). Най-често пречещият фактор при образуването на α-спирала е аминокиселината пролин. В допълнение, пролинът не образува вътрешноверижна водородна връзка поради отсъствието на водороден атом при азотния атом. По този начин, във всички случаи, когато пролинът се намира в полипептидна верига, а-спиралната структура се нарушава и се образува намотка или (b-завой). б-Структура.За разлика от a-спиралата, b-структурата се образува поради кръстосана веригаводородни връзки между съседни участъци на полипептидната верига, тъй като няма вътреверижни контакти. Ако тези секции са насочени в една посока, тогава такава структура се нарича паралелна, но ако в обратна посока, тогава антипаралелна. Полипептидната верига в b-структурата е силно удължена и няма спираловидна, а по-скоро зигзагообразна форма. Разстоянието между съседните аминокиселинни остатъци по оста е 0,35 nm, т.е. три пъти по-голямо, отколкото в a-спирала, броят на остатъците на завъртане е 2. В случай на паралелно разположение на b-структурата, водородните връзки са по-малко силни в сравнение с тези с антипаралелно подреждане на аминокиселинните остатъци. За разлика от a-спиралата, която е наситена с водородни връзки, всеки участък от полипептидната верига в b-структурата е отворен за образуване на допълнителни водородни връзки. Горното се отнася както за паралелни, така и за антипаралелни b-структури, но в антипаралелната структура връзките са по-стабилни. Сегментът на полипептидната верига, който образува b-структурата, съдържа от три до седем аминокиселинни остатъка, а самата b-структура се състои от 2-6 вериги, въпреки че техният брой може да бъде по-голям. В-структурата има нагъната форма в зависимост от съответните а-въглеродни атоми. Повърхността му може да бъде равна и лява, така че ъгълът между отделните участъци на веригата да е 20-25°. b-Огъване.Глобуларните протеини имат сферична форма до голяма степен поради факта, че полипептидната верига се характеризира с наличието на бримки, зигзаги, фиби, като посоката на веригата може да се промени дори на 180 °. В последния случай се получава b-огъване. Това огъване е оформено като фиби и е стабилизирано от единична водородна връзка. Факторът, предотвратяващ образуването му, може да бъде големи странични радикали, поради което често се наблюдава включването на най-малкия аминокиселинен остатък, глицин. Тази конфигурация винаги се появява на повърхността на протеиновата глобула и следователно B-завоят участва във взаимодействието с други полипептидни вериги. Супервторични структури.Свръхвторичните структури на протеините първо бяха постулирани и след това открити от L. Pauling и R. Corey. Пример е суперспирална α-спирала, в която две α-спирали са усукани в лява суперспирала. Въпреки това, по-често суперспиралните структури включват както а-спирали, така и b-нагънати листове. Съставът им може да бъде представен по следния начин: (aa), (ab), (ba) и (bXb). Последният вариант се състои от два паралелно сгънати листа, между които има статистическа намотка (bСb).Връзката между вторичните и супервторичните структури има висока степен на вариабилност и зависи от индивидуалните характеристики на определена протеинова макромолекула. Домейните са по-сложни нива на организация на вторична структура. Те са изолирани глобуларни участъци, свързани помежду си чрез къси така наречени шарнирни участъци на полипептидната верига. D. Birktoft е един от първите, които описват доменната организация на химотрипсина, отбелязвайки наличието на два домена в този протеин.
Вторична структура на протеина
Вторичната структура е начинът, по който полипептидната верига е подредена в подредена структура. Вторичната структура се определя от първичната структура. Тъй като първичната структура е генетично определена, образуването на вторична структура може да възникне, когато полипептидната верига напусне рибозомата. Вторичната структура е стабилизирана водородни връзки, които се образуват между NH и CO групите на пептидните връзки.
Разграничете a-спирала, b-структураи нарушена конформация (кълбо).
Структура α-спирали беше предложено ПолингИ Кори(1951 г.). Това е вид протеинова вторична структура, която изглежда като правилна спирала (фиг.
Конформация на полипептидната верига. Вторична структура на полипептидната верига
2.2). α-спиралата е пръчковидна структура, в която пептидните връзки са разположени вътре в спиралата, а аминокиселинните радикали на страничната верига са разположени отвън. А-спиралата се стабилизира от водородни връзки, които са успоредни на оста на спиралата и се срещат между първия и петия аминокиселинен остатък. По този начин, в разширени спирални области, всеки аминокиселинен остатък участва в образуването на две водородни връзки.

Ориз. 2.2. Структура на α-спирала.
Има 3,6 аминокиселинни остатъка на завъртане на спиралата, стъпката на спиралата е 0,54 nm и има 0,15 nm на аминокиселинен остатък. Ъгълът на спиралата е 26°. Периодът на редовност на a-спирала е 5 завъртания или 18 аминокиселинни остатъка. Най-разпространени са десните а-спирали, т.е. Спиралата се завърта по посока на часовниковата стрелка. Образуването на а-спирала се предотвратява от пролин, аминокиселини със заредени и обемисти радикали (електростатични и механични препятствия).
Друга спираловидна форма присъства в колаген . В тялото на бозайниците колагенът е количествено преобладаващият протеин: той съставлява 25% от общия протеин. Колагенът присъства в различни форми, предимно в съединителната тъкан. Това е лява спирала със стъпка от 0,96 nm и 3,3 остатъка на завъртане, по-плоска от α-спиралата. За разлика от α-спиралата, тук е невъзможно образуването на водородни мостове. Колагенът има необичаен аминокиселинен състав: 1/3 е глицин, приблизително 10% пролин, както и хидроксипролин и хидроксилизин. Последните две аминокиселини се образуват след биосинтеза на колаген чрез посттранслационна модификация. В структурата на колагена триплетът gly-X-Y постоянно се повтаря, като позицията X често е заета от пролин, а позицията Y от хидроксилизин. Има добри доказателства, че колагенът присъства повсеместно като дясна тройна спирала, усукана от три първични леви спирали. В тройна спирала всеки трети остатък завършва в центъра, където по пространствени причини се вписва само глицинът. Цялата колагенова молекула е с дължина около 300 nm.
б-Структура(b-нагънат слой). Намира се в глобуларни протеини, както и в някои фибриларни протеини, например копринен фиброин (фиг. 2.3).
Ориз. 2.3. б-Структура
Структурата има плоска форма. Полипептидните вериги са почти напълно удължени, а не плътно усукани, както при a-спирала. Равнините на пептидните връзки са разположени в пространството като еднакви гънки на лист хартия. Той се стабилизира чрез водородни връзки между CO и NH групите на пептидните връзки на съседни полипептидни вериги. Ако полипептидните вериги, образуващи b-структурата, вървят в една и съща посока (т.е. C- и N-краищата съвпадат) – паралелна b-структура; ако обратното - антипаралелна b-структура. Страничните радикали на един слой се поставят между страничните радикали на друг слой. Ако една полипептидна верига се огъне и върви успоредно на себе си, тогава това антипаралелна b-кръстосана структура. Водородните връзки в b-кръстосаната структура се образуват между пептидните групи на бримките на полипептидната верига.
Съдържанието на а-спирали в изследваните до момента протеини е изключително променливо. В някои протеини, например миоглобин и хемоглобин, а-спиралата е в основата на структурата и представлява 75%, в лизозима - 42%, в пепсина само 30%. Други протеини, например храносмилателният ензим химотрипсин, практически са лишени от а-спирална структура и значителна част от полипептидната верига се вписва в слоести b-структури. Поддържащите тъканни протеини колаген (протеин на сухожилията и кожата), фиброин (естествен копринен протеин) имат b-конфигурация на полипептидни вериги.
Доказано е, че образуването на α-спирали се улеснява от glu, ala, leu, а β-структурите от met, val, ile; на местата, където полипептидната верига се огъва - gly, pro, asn. Смята се, че шест групирани остатъка, четири от които допринасят за образуването на спиралата, могат да се считат за център на спирализиране. От този център има растеж на спирали в двете посоки до участък - тетрапептид, състоящ се от остатъци, които предотвратяват образуването на тези спирали. По време на образуването на β-структурата ролята на праймери се изпълнява от три от пет аминокиселинни остатъка, които допринасят за образуването на β-структурата.
В повечето структурни протеини преобладава една от вторичните структури, което се определя от техния аминокиселинен състав. Структурен протеин, изграден предимно под формата на α-спирала, е α-кератин. Животинските косми (козина), пера, пера, нокти и копита са съставени основно от кератин. Като компонент на междинните филаменти, кератинът (цитокератин) е основен компонент на цитоскелета. В кератините по-голямата част от пептидната верига е нагъната в дясна α-спирала. Две пептидни вериги образуват една лява супер спирала.Суперспиралните кератинови димери се комбинират в тетрамери, които се агрегират, за да се образуват протофибрилис диаметър 3 nm. Накрая се образуват осем протофибрили микрофибрилис диаметър 10 nm.
Косата е изградена от същите фибрили. Така в едно вълнено влакно с диаметър 20 микрона се преплитат милиони фибрили. Индивидуалните кератинови вериги са омрежени чрез множество дисулфидни връзки, което им придава допълнителна здравина. По време на къдрене протичат следните процеси: първо дисулфидните мостове се разрушават чрез редукция с тиоли и след това, за да се придаде необходимата форма на косата, тя се изсушава чрез нагряване. В същото време, поради окисление от кислорода на въздуха, се образуват нови дисулфидни мостове, които запазват формата на прическата.
Коприната се получава от пашкули на гъсеници на копринени буби ( Bombyx mori) и сродни видове. Основният протеин на коприната, фиброин, има структурата на антипаралелен сгънат слой, а самите слоеве са разположени успоредно един на друг, образувайки множество слоеве. Тъй като в нагънатите структури страничните вериги на аминокиселинните остатъци са ориентирани вертикално нагоре и надолу, само компактни групи могат да се поберат в пространствата между отделните слоеве. Всъщност фиброинът се състои от 80% глицин, аланин и серин, т.е. три аминокиселини, характеризиращи се с минимален размер на страничната верига. Молекулата на фиброина съдържа типичен повтарящ се фрагмент (gli-ala-gli-ala-gli-ser)n.
Нарушена конформация.Регионите на протеинова молекула, които не принадлежат към спираловидни или нагънати структури, се наричат неподредени.
Надвторична структура.Алфа спиралните и бета структурните области в протеините могат да взаимодействат помежду си и помежду си, образувайки сглобки. Супра-вторичните структури, открити в естествените протеини, са енергийно най-предпочитани. Те включват суперспирална α-спирала, в която две α-спирали са усукани една спрямо друга, образувайки лява суперспирала (бактериородопсин, хемеритрин); редуващи се α-спирални и β-структурни фрагменти на полипептидната верига (например, βαβαβ връзката на Rossmann, намерена в NAD+-свързващия регион на ензимни молекули дехидрогеназа); антипаралелната триверижна β структура (βββ) се нарича β-зигзаг и се намира в редица микробни, протозойни и гръбначни ензими.
Предишна234567891011121314151617Следваща
ВИЖ ПОВЕЧЕ:
ПРОТЕИНИ Вариант 1 А1.Структурните единици на протеините са: ...
5 - 9 клас
ПРОТЕИНИ
Опция 1
А1.Структурните единици на протеините са:
а)
Амини
IN)
Аминокиселини
б)
Глюкоза
G)
Нуклеотиди
A2. Образуването на спирала се характеризира с:
а)
Първична протеинова структура
IN)
Третична структура на протеина
б)
Вторична структура на протеина
G)
Кватернерна протеинова структура
A3. Какви фактори причиняват необратима денатурация на протеина?
а)
Взаимодействие с разтвори на оловни, железни и живачни соли
б)
Въздействие върху протеина с концентриран разтвор на азотна киселина
IN)
Силна топлина
G)
Всички горепосочени фактори са верни
A4. Посочете какво се наблюдава, когато концентрирана азотна киселина се приложи към протеинови разтвори:
а)
Бяла утайка
IN)
Червено-виолетово оцветяване
б)
Черна утайка
G)
Жълто оцветяване
A5. Протеините, които изпълняват каталитична функция, се наричат:
а)
Хормони
IN)
Ензими
б)
витамини
G)
протеини
A6. Протеинът хемоглобин изпълнява следните функции:
а)
Каталитичен
IN)
Строителство
б)
Защитен
G)
транспорт
Част Б
B1. Съвпада:
Тип протеинова молекула
Имот
1)
Глобуларни протеини
а)
Молекулата е свита на топка
2)
Фибриларни протеини
б)
Не се разтваря във вода
IN)
Разтваря се във вода или образува колоидни разтвори
G)
Нишковидна структура
Вторична структура
Протеини:
а)
Изграден от аминокиселинни остатъци
б)
Съдържа само въглерод, водород и кислород
IN)
Хидролизира в кисела и алкална среда
G)
Възможност за денатурация
Д)
Те са полизахариди
Д)
Те са естествени полимери
Част В
C1. Напишете уравненията на реакциите, чрез които може да се получи глицин от етанол и неорганични вещества.
Името "катерици" идва от способността на много от тях да побеляват при нагряване. Името "протеини" идва от гръцката дума за "първи", което показва тяхното значение в тялото. Колкото по-високо е нивото на организация на живите същества, толкова по-разнообразен е съставът на протеините.
Протеините се образуват от аминокиселини, които са свързани помежду си чрез ковалентни връзки. пептид връзка: между карбоксилната група на една аминокиселина и аминогрупата на друга. Когато две аминокиселини взаимодействат, се образува дипептид (от остатъците на две аминокиселини, от гръцки. пептос– варени). Заместването, изключването или пренареждането на аминокиселини в полипептидна верига причинява появата на нови протеини. Например, при замяна само на една аминокиселина (глутамин с валин) възниква сериозно заболяване - сърповидно-клетъчна анемия, когато червените кръвни клетки имат различна форма и не могат да изпълняват основните си функции (пренос на кислород). Когато се образува пептидна връзка, водната молекула се отделя. В зависимост от броя на аминокиселинните остатъци се разграничават:
– олигопептиди (ди-, три-, тетрапептиди и др.) – съдържат до 20 аминокиселинни остатъка;
– полипептиди – от 20 до 50 аминокиселинни остатъка;
– катерици – над 50, понякога хиляди аминокиселинни остатъци
Въз основа на техните физикохимични свойства протеините се разграничават на хидрофилни и хидрофобни.
Има четири нива на организация на белтъчната молекула – еквивалентни пространствени структури (конфигурации, потвърждение) протеини: първични, вторични, третични и кватернерни.
Първичен структурата на протеините е най-проста. Той има формата на полипептидна верига, където аминокиселините са свързани една с друга чрез силна пептидна връзка. Определя се от качествения и количествен състав на аминокиселините и тяхната последователност.
Вторична структура на протеините
Втори структурата се формира предимно от водородни връзки, които са образувани между водородните атоми на NH групата на едната спирала и кислородните атоми на CO групата на другата и са насочени по спиралата или между успоредни гънки на протеиновата молекула. Белтъчната молекула е частично или изцяло усукана в α-спирала или образува β-листова структура. Например, кератиновите протеини образуват α-спирала. Те са част от копита, рога, коса, пера, нокти и нокти. Протеините, които изграждат коприната, имат β-лист. Аминокиселинните радикали (R-групи) остават извън спиралата. Водородните връзки са много по-слаби от ковалентните връзки, но със значителен брой от тях те образуват доста силна структура.
Функционирането под формата на усукана спирала е характерно за някои фибриларни протеини - миозин, актин, фибриноген, колаген и др.
Третична структура на протеина
Третичен протеинова структура. Тази структура е постоянна и уникална за всеки протеин. Определя се от размера, полярността на R-групите, формата и последователността на аминокиселинните остатъци. Полипептидната спирала е усукана и сгъната по определен начин. Образуването на третичната структура на протеина води до образуването на специална конфигурация на протеина - глобули (от латински globulus - топка). Образуването му се определя от различни видове нековалентни взаимодействия: хидрофобни, водородни, йонни. Между аминокиселинните остатъци на цистеин се появяват дисулфидни мостове.
Хидрофобните връзки са слаби връзки между неполярни странични вериги, които са резултат от взаимното отблъскване на молекулите на разтворителя. В този случай протеинът се усуква така, че хидрофобните странични вериги са потопени дълбоко в молекулата и я предпазват от взаимодействие с вода, докато хидрофилните странични вериги са разположени отвън.
Повечето протеини имат третична структура – глобулини, албумини и др.
Кватернерна протеинова структура
кватернер протеинова структура. Образува се в резултат на комбинацията от отделни полипептидни вериги. Заедно те образуват функционална единица. Има различни видове връзки: хидрофобни, водородни, електростатични, йонни.
Електростатични връзки възникват между електроотрицателни и електроположителни радикали на аминокиселинни остатъци.
Някои протеини се характеризират с глобуларно подреждане на субединици - това е кълбовиден протеини. Глобуларните протеини лесно се разтварят във вода или солеви разтвори. Над 1000 известни ензима принадлежат към глобуларните протеини. Глобуларните протеини включват някои хормони, антитела и транспортни протеини. Например сложната молекула на хемоглобина (белтък на червените кръвни клетки) е глобуларен протеин и се състои от четири глобинови макромолекули: две α-вериги и две β-вериги, всяка от които е свързана с хема, който съдържа желязо.
Други протеини се характеризират с асоцииране в спирални структури - това е фибриларен (от лат. fibrilla - влакно) протеини. Няколко (3 до 7) α-спирали са усукани заедно, като влакна в кабел. Фибриларните протеини са неразтворими във вода.
Протеините се делят на прости и сложни.
Прости протеини (протеини)
Прости протеини (протеини) се състои само от аминокиселинни остатъци. Простите протеини включват глобулини, албумини, глутелини, проламини, протамини, бутала. Албумините (например серумен албумин) са разтворими във вода, глобулините (например антитела) са неразтворими във вода, но са разтворими във водни разтвори на определени соли (натриев хлорид и др.).
Сложни протеини (протеиди)
Сложни протеини (протеиди) включват освен аминокиселинни остатъци и съединения от различен характер, които се наричат протезен група. Например, металопротеините са протеини, съдържащи нехемово желязо или свързани с метални атоми (повечето ензими), нуклеопротеините са протеини, свързани с нуклеинови киселини (хромозоми и т.н.), фосфопротеините са протеини, които съдържат остатъци от фосфорна киселина (яйчни протеини, жълтък и др.). ), гликопротеини - протеини, комбинирани с въглехидрати (някои хормони, антитела и др.), Хромопротеини - протеини, съдържащи пигменти (миоглобин и др.), Липопротеини - протеини, съдържащи липиди (включени в състава на мембраните).
Конформацията е пространственото разположение в органична молекула на заместващи групи, които могат свободно да променят позицията си в пространството, без да разкъсват връзки, поради свободно въртене около единични въглеродни връзки.
Има 2 вида протеинова вторична структура:
- 1. b-спирала
- 2. c-сгъване.
Вторичната структура е стабилизирана от водородни връзки. Водородните връзки възникват между водородния атом в NH групата и карбоксилния кислород.
Характеристики на b-спирала.
B-спиралата е стабилизирана от водородни връзки, които възникват между всяка първа и четвърта аминокиселина. Стъпката на спиралата включва 3,6 аминокиселинни остатъка.
Образуването на b-спирала става по посока на часовниковата стрелка (дясна спирала), тъй като естествените протеини се състоят от L-аминокиселини.
Всеки протеин се характеризира със собствена степен на спиралност на полипептидната верига. Спиралните участъци се редуват с линейни. В молекулата на хемоглобина b и b веригите са спирални с 75%, в лизозима - 42%, в пепсина - 30%.
Степента на спирализиране зависи от първичната структура на протеина.
B-спиралата се образува спонтанно и е най-стабилната конформация на полипептидната верига, съответстваща на минималната свободна енергия.
Всички пептидни групи участват в образуването на водородни връзки. Това осигурява максимална стабилност на b-спиралата.
Тъй като всички хидрофилни групи на пептидния скелет обикновено участват в образуването на водородни връзки, хидрофобността на алфа спиралите се увеличава.
Аминокиселинните радикали са разположени от външната страна на алфа спиралите и са насочени встрани от пептидния скелет. Те не участват в образуването на водородни връзки и са характерни за вторичната структура, но някои от тях могат да нарушат образуването на алфа спирали:
Пролин. Неговият азотен атом е част от твърд пръстен, което елиминира възможността за въртене около N-CH връзки. В допълнение, азотният атом на пролина, който образува връзка с друга аминокиселина, няма водород. В резултат на това пролинът не е в състояние да образува водородна връзка и структурата на алфа спиралите е нарушена. Обикновено това е мястото, където се получава примка или огъване.
Области, където последователно са разположени няколко еднакво заредени радикали, между които възникват електростатични сили на отблъскване.
Области с плътно разположени обемисти радикали, които механично нарушават образуването на алфа спирали, например метионин, триптофан.
Аминокиселината пролин предотвратява спирализацията на протеиновата молекула.
c-нагъването има леко извита конфигурация на полипептидната верига.
Ако свързаните полипептидни вериги са насочени в противоположни посоки, възниква антипаралелна β-структура, но ако N и C краищата на полипептидните вериги съвпадат, се появява структурата на паралелен β-нагънат слой.
β-нагъването се характеризира с водородни връзки в рамките на единична полипептидна верига или сложни полипептидни вериги.
В протеините са възможни преходи от b-спирала към b-нагъване и обратно поради пренареждане на водородните връзки.
B-сгъването има плоска форма.
B-спиралата има пръчковидна форма.
Водородните връзки са слаби връзки, енергията на връзката е 10 - 20 kcal/mol, но голям брой връзки осигуряват стабилността на протеиновата молекула.
В протеиновата молекула има силни (ковалентни) връзки, както и слаби, което осигурява стабилността на молекулата от една страна и лабилността от друга.
Животът на нашата планета произхожда от коацерватна капчица. Това също беше протеинова молекула. Тоест следва изводът, че тези химични съединения са в основата на всички живи същества, които съществуват днес. Но какво представляват протеиновите структури? Каква роля играят те в тялото и живота на хората днес? Какви видове протеини има? Нека се опитаме да го разберем.
Протеини: общо понятие
От гледна точка, молекулата на въпросното вещество е последователност от аминокиселини, свързани с пептидни връзки.
Всяка аминокиселина има две функционални групи:
- карбоксил -СООН;
- амино група -NH2.
Именно между тях се образуват връзки в различни молекули. По този начин пептидната връзка е под формата -CO-NH. Една протеинова молекула може да съдържа стотици или хиляди такива групи; това ще зависи от конкретното вещество. Видовете протеини са много разнообразни. Сред тях има такива, които съдържат незаменими за организма аминокиселини, което означава, че трябва да се доставят на тялото с храната. Има разновидности, които изпълняват важни функции в клетъчната мембрана и нейната цитоплазма. Изолират се и биологични катализатори – ензими, които също са белтъчни молекули. Те намират широко приложение в човешкото ежедневие, а не само участват в биохимичните процеси на живите същества.
Молекулното тегло на разглежданите съединения може да варира от няколко десетки до милиони. В крайна сметка броят на мономерните единици в голяма полипептидна верига е неограничен и зависи от вида на конкретното вещество. Протеинът в неговата чиста форма, в естествената му конформация, може да се види при изследване на пилешко яйце в светложълта, прозрачна гъста колоидна маса, вътре в която се намира жълтъкът - това е желаното вещество. Същото може да се каже и за нискомасленото извара.Този продукт също е почти чист протеин в естествената си форма.

Въпреки това, не всички разглеждани съединения имат еднаква пространствена структура. Има общо четири молекулярни организации. Видовете определят неговите свойства и говорят за сложността на структурата му. Известно е също, че по-пространствено заплетените молекули се подлагат на интензивна обработка при хора и животни.
Видове протеинови структури
Те са общо четири. Нека да разгледаме какво представлява всеки от тях.
- Първичен. Това е обща линейна последователност от аминокиселини, свързани с пептидни връзки. Няма пространствени усуквания или спирализиране. Броят на единиците, включени в полипептида, може да достигне няколко хиляди. Видове протеини с подобна структура са глицилаланин, инсулин, хистони, еластин и др.
- Втори. Състои се от две полипептидни вериги, които са усукани под формата на спирала и ориентирани една към друга от образуваните завои. В същото време между тях възникват водородни връзки, които ги държат заедно. Така се образува една единствена протеинова молекула. Видовете протеини от този тип са следните: лизозим, пепсин и други.
- Третична конформация. Това е плътно опакована и компактно събрана вторична структура. Тук се появяват други видове взаимодействия, в допълнение към водородните връзки - това са взаимодействието на Ван дер Ваалс и силите на електростатично привличане, хидрофилно-хидрофобен контакт. Примери за структури са албумин, фиброин, копринен протеин и други.
- кватернер. Най-сложната структура, която се състои от няколко полипептидни вериги, усукани в спирала, навити на топка и комбинирани заедно в глобула. Примери като инсулин, феритин, хемоглобин и колаген илюстрират точно такава протеинова конформация.
Ако разгледаме подробно всички дадени молекулярни структури от химическа гледна точка, анализът ще отнеме много време. Наистина, колкото по-висока е конфигурацията, толкова по-сложна и сложна е нейната структура, толкова повече видове взаимодействия се наблюдават в молекулата.

Денатурация на протеинови молекули
Едно от най-важните химични свойства на полипептидите е способността им да се разрушават под въздействието на определени условия или химични агенти. Например, различни видове денатурация на протеини са широко разпространени. Какъв е този процес? Състои се в разрушаване на естествената структура на протеина. Тоест, ако молекулата първоначално е имала третична структура, след действието на специални агенти тя ще се срине. Но последователността на аминокиселинните остатъци остава непроменена в молекулата. Денатурираните протеини бързо губят своите физични и химични свойства.
Какви реагенти могат да доведат до процеса на разрушаване на конформацията? Има няколко от тях.
- температура. При нагряване настъпва постепенно разрушаване на кватернерната, третичната и вторичната структура на молекулата. Това може да се наблюдава визуално, например при пържене на обикновено пилешко яйце. Полученият "протеин" е първичната структура на албуминовия полипептид, който е бил в суровия продукт.
- Радиация.
- Действие на силни химични агенти: киселини, основи, соли на тежки метали, разтворители (например алкохоли, етери, бензол и други).
Този процес понякога се нарича още молекулярно топене. Видовете денатурация на протеини зависят от агента, чието действие го е причинило. В някои случаи протича процесът, обратен на разглеждания. Това е ренатурация. Не всички протеини са в състояние да възстановят структурата си обратно, но значителна част от тях могат да направят това. Така химици от Австралия и Америка извършиха ренатурация на варено пилешко яйце, използвайки някои реактиви и метод на центрофугиране.
Този процес е важен за живите организми по време на синтеза на полипептидни вериги от рибозоми и рРНК в клетките.

Хидролиза на протеинова молекула
Наред с денатурацията, белтъчините се характеризират с още едно химично свойство - хидролиза. Това също е разрушаване на нативната конформация, но не на първичната структура, а изцяло на отделните аминокиселини. Важна част от храносмилането е протеиновата хидролиза. Видовете хидролиза на полипептидите са както следва.
- химически. Въз основа на действието на киселини или основи.
- Биологичен или ензимен.
Но същността на процеса остава непроменена и не зависи от това какви видове протеинова хидролиза се извършват. В резултат на това се образуват аминокиселини, които се транспортират във всички клетки, органи и тъкани. Тяхната по-нататъшна трансформация включва синтеза на нови полипептиди, които вече са необходими за даден организъм.
В индустрията процесът на хидролиза на протеинови молекули се използва именно за получаване на необходимите аминокиселини.

Функции на протеините в организма
Различни видове протеини, въглехидрати, мазнини са жизненоважни компоненти за нормалното функциониране на всяка клетка. А това означава целият организъм като цяло. Следователно тяхната роля до голяма степен се обяснява с високата степен на значимост и повсеместност сред живите същества. Могат да бъдат разграничени няколко основни функции на полипептидните молекули.
- Каталитичен. Осъществява се от ензими, които имат протеинова структура. Ще говорим за тях по-късно.
- Структурни. Видовете протеини и техните функции в тялото засягат преди всичко структурата на самата клетка, нейната форма. В допълнение, полипептидите, които изпълняват тази роля, образуват коса, нокти, черупки на мекотели и пера на птици. Те са и известно подсилване в клетъчното тяло. Хрущялът също се състои от тези видове протеини. Примери: тубулин, кератин, актин и др.
- Регулаторен. Тази функция се проявява в участието на полипептидите в процеси като транскрипция, транслация, клетъчен цикъл, сплайсинг, четене на иРНК и други. Във всички тях те играят важна роля на регулатор.
- Сигнал. Тази функция се изпълнява от протеини, разположени върху клетъчната мембрана. Те предават различни сигнали от едно звено към друго и това води до комуникация между тъканите. Примери: цитокини, инсулин, растежни фактори и други.
- транспорт. Някои видове протеини и техните функции, които изпълняват, са просто жизненоважни. Това се случва например с протеина хемоглобин. Той пренася кислород от клетка на клетка в кръвта. За човека е незаменим.
- Резервен или резервен. Такива полипептиди се натрупват в растенията и животинските яйца като източник на допълнително хранене и енергия. Пример са глобулините.
- Мотор. Много важна функция, особено за протозои и бактерии. В края на краищата те могат да се движат само с помощта на флагели или реснички. И тези органели по своята природа не са нищо повече от протеини. Примери за такива полипептиди са следните: миозин, актин, кинезин и др.
Очевидно е, че функциите на протеините в човешкото тяло и други живи същества са многобройни и важни. Това още веднъж потвърждава, че без съединенията, които разглеждаме, животът на нашата планета е невъзможен.

Защитна функция на протеините
Полипептидите могат да предпазват от различни влияния: химически, физически, биологични. Например, ако тялото е застрашено от вирус или бактерия с чужда природа, тогава имуноглобулините (антитела) влизат в битка с тях, изпълнявайки защитна роля.
Ако говорим за физически ефекти, тогава голяма роля тук играят например фибринът и фибриногенът, които участват в съсирването на кръвта.
Хранителни протеини
Видовете диетичен протеин са както следва:
- пълноценни - такива, които съдържат всички необходими на организма аминокиселини;
- долни - тези, които съдържат непълен аминокиселинен състав.
И двете обаче са важни за човешкото тяло. Особено първата група. Всеки човек, особено в периоди на интензивно развитие (детство и юношество) и пубертет, трябва да поддържа постоянно ниво на протеини в себе си. В края на краищата ние вече разгледахме функциите, които изпълняват тези невероятни молекули, и знаем, че практически нито един процес, нито една биохимична реакция в нас не е завършена без участието на полипептиди.
Ето защо е необходимо всеки ден да се консумират дневните количества протеини, които се съдържат в следните продукти:
- яйце;
- мляко;
- извара;
- месо и риба;
- боб;
- боб;
- фъстък;
- пшеница;
- овесени ядки;
- леща и др.
Ако консумирате 0,6 g полипептид на ден на kg тегло, тогава човек никога няма да има липса на тези съединения. Ако дълго време тялото не получава достатъчно необходими протеини, тогава възниква заболяване, наречено аминокиселинен глад. Това води до тежки метаболитни нарушения и, като следствие, много други заболявания.

Протеини в клетка
Вътре в най-малката структурна единица на всички живи същества - клетката - също има протеини. Освен това те изпълняват почти всички горепосочени функции там. На първо място се формира цитоскелетът на клетката, състоящ се от микротубули и микрофиламенти. Той служи за поддържане на формата, както и за вътрешно транспортиране между органелите. Различни йони и съединения се движат по протеинови молекули, като канали или релси.
Важна е ролята на протеините, потопени в мембраната и разположени на нейната повърхност. Тук те изпълняват както рецепторни, така и сигнални функции и участват в изграждането на самата мембрана. Те стоят на стража, което означава, че играят защитна роля. Какви видове протеини в клетката могат да бъдат класифицирани като тази група? Има много примери, ето няколко.
- Актин и миозин.
- еластин.
- Кератин.
- Колаген.
- Тубулин.
- Хемоглобин.
- Инсулин.
- Транскобаламин.
- Трансферин.
- албумин.
Общо има няколкостотин различни, които постоянно се движат във всяка клетка.
Видове протеини в тялото
Има, разбира се, огромно разнообразие от тях. Ако се опитаме по някакъв начин да разделим всички съществуващи протеини на групи, може да се стигне до нещо като тази класификация.

Като цяло можете да вземете много характеристики като основа за класифициране на протеини, открити в тялото. Все още няма един единствен.
Ензими
Биологични катализатори от протеинова природа, които значително ускоряват всички протичащи биохимични процеси. Нормалният обмен е невъзможен без тези връзки. Всички процеси на синтез и разпад, сглобяване на молекули и тяхната репликация, транслация и транскрипция и други се извършват под въздействието на определен вид ензим. Примери за тези молекули са:
- оксидоредуктази;
- трансферази;
- каталаза;
- хидролази;
- изомерази;
- лиази и др.
Днес ензимите се използват и в ежедневието. Така при производството на прахове за пране често се използват така наречените ензими - това са биологични катализатори. Подобряват качеството на пране при спазване на определените температурни условия. Лесно се свързва с частиците мръсотия и ги отстранява от повърхността на тъканите.
Въпреки това, поради своята протеинова природа, ензимите не могат да понасят твърде гореща вода или близост до алкални или киселинни лекарства. Всъщност в този случай ще настъпи процесът на денатурация.